|
|
Адсорбция на поверхности раздела твердое вещество — жидкостьЯвления адсорбции чрезвычайно широко распространены в природе. Там, где соприкасаются газы (или пары), жидкости и твердые тела, имеют место адсорбционные процессы. Почва хорошо поглощает (адсорбирует) не только растворенные в воде органические и минеральные соединения, но и воздух, углекислоту, пары воды, аммиак. Поглощение корнями питательных элементов из почвы начинается с их адсорбции на поверхности корневых волосков и тонких неопробковевших корней. Усвоение растением углекислого газа при фотосинтезе начинается с адсорбции СО2 на внутренней поверхности листа. Превращения поглощенных солей и углекислоты связаны с явлениями адсорбции и десорбции на протоплазматических структурах и поверхностях клеточных органелл, пластид, митохондрий, микросом. Явления адсорбции играют очень большую роль также и в жизнедеятельности животных организмов. Роль адсорбции обусловлена наличием в организме огромного количества самых разнообразных поверхностей раздела — стенок сосудов, поверхности клеток, клеточных ядер и вакуолей, коллоидных частиц протоплазмы и, наконец, поверхности раздела между организмом и средой. Особенно важна функция поверхности раздела между организмом и средой у низших организмов и организмов, живущих в воде, так как этой поверхности принадлежит существенная роль в процессах питания и обмена веществ. Исследования последних лет показали, что пищевые вещества, как правило, являются поверхностно-активными, и потому первым этапом их усвоения является адсорбция, а процесс их химического превращения уже вторичен. Чтобы наглядно представить роль и значение адсорбционных процессов, протекающих в животном организме, рассмотрим адсорбционные возможности эритроцитов крови человека. Исследования показали, что эритроциты являются переносчиками различных веществ, в том числе аминокислот, которые они разносят и передают клеткам и различным тканям организма. Количество эритроцитов в крови взрослого человека примерно 5 000 000 в 1 нм3. У здорового мужчины в среднем на 1 кг массы приходится 450 миллиардов эритроцитов, 27 триллионов на весь организм. Учитывая, что диаметр эритроцита 7—8 мкм, можно легко подсчитать, что общая поверхность эритроцитов всей крови человека составит примерно 3200 м2. Большинство реакций, протекающих в организме, совершается при непосредственном участии ферментов-катализаторов. Исследования показали, что первые стадии действия любого фермента сводятся к адсорбции субстрата на поверхности ферментного комплекса, и только после этого фермент проявляет свое специфическое каталитическое действие. Адсорбционная способность может быть увеличена, если адсорбент имеет пористую структуру. Пористые адсорбенты бывают как минеральные , так и органичсекие. Минеральные – широко применяются для осветления и стабилизации фруктово-ягодных соков , растительных масел ,очистки питьевой и технической воды , в качестве осушителей пищевых продуктов и др.
Вопросы для самоподготовки
1. Понятие о поверхностной энергии и поверхностном натяжении. Методы их измерения. Способы уменьшения свободной энергии системы. 2. Что такое адсорбция? Виды адсорбции. Уравнения Гиббса. 3. Поверхностно-активные вещества (ПАВ), особенности их строения и действия; примеры применения в сельском хозяйстве. 4. Опишите адсорбцию на твердых адсорбентах. 5. Что является мерой смачивания. Приведите примеры гидрофильных и гидрофобных поверхностей, каково их значение в сельском хозяйстве. 6. Понятие о поверхностной энергии и поверхностном натяжении. Методы их измерения. Способы уменьшения свободной энергии системы. 7. Что такое адсорбция? Виды адсорбции. Уравнения Гиббса. 8. Поверхностно-активные вещества (ПАВ), особенности их строения и действия; примеры применения в сельском хозяйстве. 9. Опишите адсорбцию на твердых адсорбентах. 10 Что является мерой смачивания. Приведите примеры гидрофильных и гидрофобных поверхностей, каково их значение в сельском хозяйстве. 11 .Охарактеризуйте изотермы сорбции по Ленгмюру и Фрейндлиху, поясните БЭТ- изотерму. 12. Ионный обмен и его закономерности. Запишите уравнение ионообменного равновесия Б.П. Никольского. 13. Сущность поглотительной способности почв и ее значение для агрономической науки. Роль адсорбционных процессов в природных явлениях.
Как ранее было сказано, при изучении адсорбции веществ на жидких поверхностях наиболее удобным методом является измерение поверхностного натяжения жидкостей, так как мерой адсорбции на границе раздела жидкость – газ и жидкость-жидкость является уменьшение поверхностного натяжения с увеличением концентрации раствора. Величину адсорбции на жидкой поверхности можно определить, измерив поверхностное натяжение, для чего существует несколько различных методов. Важнейшими из них являются следующие: метод капиллярного поднятия, сталагмометрический метод, метод наибольшего давления пузырьков, метод отрыва кольца. В данном практикуме предполагается определение поверхностного натяжения с последующим расчетом величины адсорбции на жидких адсорбентах методом наибольшего давления пузырьков воздуха ( метод Ребиндера ) и метод капиллярного поднятия жидкости.. Метод Ребиндера основан на измерении давления Р, необходимого для выделения воздуха из стеклянного капилляра в жидкость ( воду ) и зависит от радиуса капилляра, через который проскакивает пузырек. В качестве стандарта используют чистые жидкости которые при постоянной температуре имеют постоянную величину поверхностного натяжения. Например, при 20оС коэффициент поверхностного натяжения ( сигма - s ) равен: для воды 72,75; ртути – 475,00; этилового спирта – 22,0; бутилового спирта – 24,60*10 –3 Н/м. (см. Приложение табл. 4).
ЗАДАНИЯ К ЛАБОРАТОРНОЙ РАБОТЕ ПО ТЕМЕ 5
ЗАДАНИЕ 1. Определение величины адсорбции поверхностно-активных веществ на жидкой поверхности методом Ребиндера. Цель работы. 1. Освоить методику определения поверхностного натяжения жидкостей по методу Ребиндера (с 316-319 ). 2. Определить поверхностное натяжение растворов бутилового спирта разных концентраций. 3. Рассчитать величину адсорбции бутилового спирта на воде и построить изотермы адсорбции и поверхностного натяжения. 4.Сделать выводы о принадлежности бутилового спирта к поверхностно-активным веществам (ПАВ).
ЗАДАНИЕ 2. Определение поверхностного натяжения и установление влияния длины цепи на поверхностное натяжение алифатических спиртов. Цель работы . 1. Освоить методику определения поверхностного натяжения жидкостей по методу Ребиндера (с 319 ). 2. Определить поверхностное натяжение спиртов при постоянной температуре. 3. Изобразить графически зависимость числа атомов углерода от поверхностного натяжения. 4. Сделать вывод об экспериментальном подтверждении правила Траубе-Дюкло.
ЗАДАНИЕ 3. Определение величины адсорбции поверхностно-активных веществ на жидкой поверхности методом поднятия жидкости в капилляре. Цель работы. 1. Освоить методику определения поверхностного натяжения по методу капиллярного поднятия жидкостей (с.320-322 ). 2. Определить поверхностное натяжение растворов бутилового спирта разных концентраций. 3. Рассчитать величину адсорбции бутилового спирта на воде и построить изотермы адсорбции и поверхностного натяжения. 4.Сделать выводы о принадлежности бутилового спирта к поверхностно-активным веществам (ПАВ).
ЗАДАНИЕ 4. Определение поверхностного натяжения и установление влияния длины цепи на поверхностное натяжение алифатических спиртов методом поднятия жидкости в капилляре. . Цель работы . 1. 1. Освоить методику определения поверхностного натяжения й по методу капиллярного поднятия жидкостей ( с.322-323138-139 ). 2. Определить поверхностное натяжение спиртов при постоянной температуре. 3. Изобразить графически зависимость числа атомов углерода от поверхностного натяжения. 4. Сделать вывод об экспериментальном подтверждении правила Траубе-Дюкло.
ЗАДАНИЕ 5. Определение величины адсорбции уксусной ки Слоты на угле или почве.
Цель работы. 1. Освоить методику определения величины адсорбции из растворов на твердом адсорбенте ( с.323-324). 2. Определить величину адсорбции уксусной кислоты на угле или почве из растворов разной концентрации. 3.Построить изотермы адсорбции по Ленгмюру и Фрейндлиху, определить максимальную адсорбцию и константы адсорбции.
ЗАДАНИЕ 6. Определение обменных катионов Н+ в системе Почва /раствор.
Цель работы. 1. Изучить методику ионообменного метода исследования (с.324-325). 2. Определить содержание обменного катиона Н+ в почве. 3. Обобщить полученные результаты исследования для разных почв.
ЗАДАНИЕ 7. Определение содержания ионов в пробе питьевой или технической воды в пересчете на анион ОН- методом ионного обмена.
Цель работы. 1. Изучить методику ионообменного метода исследования (с.325-327 ). 2. Определить общее содержание анионов в воде в пересчете на ОН-- ион с помощью анионита ЭДЭ-10П. 3.делать выводы о возможности использования проанализированной воды в питьевых или технических целях.
МЕТОДИКИ ВЫПОЛНЕНИЯ РАБОТ
Задание 1. Определение величины адсорбции поверхностно- активных веществ на жидкой поверхности методом Ребиндера В термостат Т-прибора для определения поверхностного натяжения помещают пробирку П, заполненную испытуемой жидкостью и закрывают ее пробиркой с капилляром. Пробирка П при помощи бокового отростка соединяется с манометром М и аспиратором С. При истечении воды из аспиратора С в системе создается разряжение. Величину давления измеряют манометром М ( cм. рис. 5.9).
Рис. 9. Установка для определения поверхностного натяжения При определении постоянной капилляра пробирку П заполняют дистиллированной водой, при этом конец капилляра должен слегка касаться поверхности жидкости (не глубже, иначе нужно вводить поправку на погружение). После установления постоянной температуры выпускают воду из аспиратора с такой скоростью, чтобы воздух проскакивал отдельными пузырьками. В момент проскакивания пузырька замечают разность высоты столбов в левом и правом коленах манометра (hл и hn) и записывают значения Ро=(hл -- hn ). Заменяют дистиллированную воду в пробирке на испытуемую жидкость(растворы бутилового спирта различных концентраций),затем, предварительно промыв ею пробирку и капилляр, точно так же измеряют Рх. Результаты измерений записывают в табл. 5.2 Таблица 5.2 Данные для определения поверхностного натяжения
На основании экспериментальных данных рассчитывают поверхностное натяжение исследуемой жидкости по следующей формуле:
sх = К РХ или sх =s0
По данным таблицы 5.2 и 5.3, вычисляют величину адсорбцию по уравнению Гиббса (ур.5.6); где СР – определяется как СР(1) = Δs - рассчитывается - Δs1 = s1–s0, Δs2 = s2 – s1 и тд ΔС – находится ΔС1=С1 – С0 , ΔС2 =С2 - С1 и тд. Результатов расчетов записывают в табл. 5.3.
Таблица 5.3
На основании данных табл. 5.2 и 5.3 строят изотермы адсорбции и поверхностного натяжения, откладывая по оси абсцисс значения равновесных концентраций растворов, а по оси ординат – величины адсорбции Г в кмоль/м3 и поверхностного натяжения (d) в Н/м.В заключении по характеру изменения делают вывод о принадлежности бутилового спирта к ПАВ. Если Δσ< 0, а Г будет (+),вещество накапливается в поверхностном слое и является поверхностно - активным (ПАВ). Если Δσ > 0, Г будет отрицательной - вещество поверхностно - неактивно.
ЗАДАНИЕ 2. Определение поверхностного натяжения 0,1 М раствораспиртов жирного ряда С2Н5ОН, С3Н7ОН, С5Н11ОН, и т.д. проводят методом Ребиндера (см. методику задания 1). Результаты измерений заносят в табл. 5.4. Затем рассчитывают поверхностное натяжение спиртов по формуле (5.11) и по результатам строят график, откладывая на оси абсцисс число атомов углерода, а на оси ординат – значения d. Понятие d в разбавленных растворах может служить мерой поверхностной активности. Найдя последовательное отношение d спиртов, необходимо показать, во сколько раз уменьшается поверхностное натяжение с удлинением углеродной цепи на группу - СН2 -, т.е., соблюдается ли правило Траубе-Дюкло (с увеличением длины углеводородной цепи на –СН2 –адсорбционная активность возрастает в 3-3,2 раза).
Таблица 5.4. Данные для определения поверхностного натяжения
ЗАДАНИЕ 3. Определение величины адсорбции поверхностно-активных веществ на жидкой поверхности методом поднятия жидкости в капилляре.
В стакан на 50 см3 наливают с помощью цилиндра 20-25 см3 дистил. воды , опускают капилляр, который должен слегка касаться поверхности жидкости и с помощью измерительной линейки измеряют уровень поднятия жидкости в капилляре. Опыт повторяют с исследуемыми жидкостями ( растворами бутилового спирта). Данные заносят в таблицу 5.5.
Таблица 5.5 Данные для определения поверхностного натяжения
Из формулы s = К h g d ( 5.12) рассчитывают К- постоянную капилляра по стандартной жидкости( дистил.воде) по уравнению К = s0// h0 g d0 (5.13) найдя ( в зависимости от температуры) значение d0 из таблицы (см. Приложение табл. ) g- сила тяжести- величина постоянная и равна 9,8 м/сек d0 - плотность дистил. воды равная 1г/см3 = 1000 кг/м3 h0 – уровень поднятия воды в капилляре. Для определения dх – плотностей исследуемых жидкостей поступают следующим образом: -взвешивают сухой стакан на 50 см3 ( подсушив его фильтровальной бумагой (m0 ); -затем , залив в него 10 см3 ( поочередно исследуемых растворов ) – снова проводят взвешивание (mх= m1,, m2, …) Данные записывают в таблицу 5.5. - плотность рассчитывают по формуле : d = mх-m0 /V (5.14) где V= 10 см3 =1*10-5м3 Поверхностное натяжение исследуемых жидкостей ( растворов бутилового спирта ) рассчитывают по формуле (5.12). По данным таблицы 5.5 и 5.6, вычисляют величину адсорбцию по уравнению Гиббса (ур.5.6); где СР – определяется как СР(1) = Δs - рассчитывается - Δs1 = s1–s0, Δs2 = s2 – s1 и тд ΔС – находится ΔС1=С1 – С0 , ΔС2 =С2 - С1 и тд. Результаты расчетов записывают в табл. 5.6.
Таблица 5.6
На основании данных табл. 5.5 и 5.6 строят изотермы адсорбции и поверхностного натяжения, откладывая по оси абсцисс значения равновесных концентраций растворов, а по оси ординат – величины адсорбции Г в кмоль/м3 и поверхностного натяжения (d) в Н/м.В заключении по характеру изменения делают вывод о принадлежности бутилового спирта к ПАВ. Если Δσ< 0, а Г будет (+),вещество накапливается в поверхностном слое и является поверхностно - активным (ПАВ). Если Δσ > 0, Г будет отрицательной - вещество поверхностно - неактивно.
ЗАДАНИЕ 4. Определение поверхностного натяжения и установление влияния длины цепи на поверхностное натяжение алифатических спиртов методом поднятия жидкости в капилляре. Опыт проводят согласно методике , описанной в задании 5.3.
Таблица 5.7 Данные для определения поверхностного натяжения
Результаты измерений заносят в табл. 5.7. Затем рассчитывают поверхностное натяжение спиртов по формуле (5.12) и по результатам строят график, откладывая на оси абсцисс число атомов углерода, а на оси ординат – значения d. Понятие d в разбавленных растворах может служить мерой поверхностной активности. Найдя последовательное отношение d спиртов, необходимо показать, во сколько раз уменьшается поверхностное натяжение с удлинением углеродной цепи на группу - СН2 -, т.е., соблюдается ли правило Траубе-Дюкло (с увеличением длины углеводородной цепи на –СН2 –адсорбционная активность возрастает в 3-3,2 раза).
ЗАДАНИЕ 5. Определение величины адсорбции уксусной кислоты на угле или почве Для изучения адсорбции уксусной кислоты активизированным углем или почвой определяют ее концентрацию в испытуемом растворе методом титрования до и после адсорбции. В титровальные колбы отбирают по 10 см3 растворов, добавляют к ним 1-2 капли раствора фенолфталеина и титруют из бюретки 0,1 н раствором щелочи до появления слабой малиновой окраски, не исчезающей в течение одной минуты. Титрование каждого раствора следует проводить в 2-3-х кратной повторности. Расчет концентрации кислоты в растворах осуществляют, используя усредненные данные результатов титрования, по формуле:
С К =
где: Ск – молярная концентрация эквивалента кислоты, моль/дм3; Сщ – молярная концентрация эквивалента щелочи, моль/дм3; Vк - объем кислоты, см3; Vщ - объем щелочи, см3.
Адсорбцию проводят в отдельных колбах, куда помещают по 1 г активированного угля или по 10 г почвы, заливают 50 см3 исходных растворов уксусной кислоты и содержимое перемешивают или встряхивают. Затем адсорбент отфильтровывают через двойной складчатый фильтр, а фильтрат используют для титрования. Результаты титрования заносят в табл. 5.8.
Таблица 5.8 Результаты титрования при адсорбции.
и по данным рассчитывают величину адсорбции по уравнению Ловица (см ур. 5.8) При изучении адсорбции из растворов для нахождения константы адсорбции удобнее применять графические выражения уравнения Фрейндлиха и Ленгмюра (см ур. 5.3 -5.5, рис 5.2, 5.3 ) Значение константы К и 1/n находят из графика изотермы адсорбции по Фрейндлиху (см ур. 5.3-5.4, рис 5.3 ) откладывая на оси абцисс значения lgC на оси ординат –lg Х / m.
ЗАДАНИЕ 6. Определение обменных катионов Н+ в системе почва -раствор 10 г воздушно-сухой почвы и 50 см3 дистиллированной воды встряхивают в конической колбе в течение 6 мин. Затем суспензию отфильтровывают через складчатый бумажный фильтр. Последние капли фильтрата наносят на полосу фильтровальной бумаги, добавляют каплю индикатора (метилового оранжевого или фенолфталеина) и проверяют наличие ионов Н+. Если индикатор дает положительную реакцию, то промывку продолжают, приливая еще 10 см3 дистиллированной воды на фильтр с почвой. Операцию продолжают до тех пор, пока индикатор не дает отрицательную реакцию на ионы Н+. Отмытую от свободный ионов Н+, почву с фильтра переносят снова в коническую колбу, смывают почву с фильтра 50 см3 1,0 н KCl, энергично встряхивают и фильтруют через бумажный складчатый фильтр в мерную колбу объемом 50 см3. Фильтрат доводят до метки водой и, отобрав 25 см3, добавляют индикатор (фенолфталеин) и титруют 0,001 н NaOH до изменения окраски индикатора. Титрование повторяют, данные заносят в табл. 5.6.
Таблица 5.9. Результаты титрования при ионном Обмене
По усредненным данным титрования рассчитывают концентрацию ионов Н+ в фильтрате, используя формулу (5.15). Затем определяют содержание Н+ в почвенном растворе и по уравнению:
mx = CH+VФЭХ 10-3 5.16
где Vф - общий объем фильтрата, см3; Эх – эквивалент определяемого иона (Э(Н+) =1)
Почва, как известно, состоит из органической и минеральной части. Содержащиеся в почве в поглощенном состоянии ионы водорода могут обмениваться в эквивалентных количествах на любые другие ионы. Общее уравнение ионного обмена Б.П.Никольского (ур. 5.10). При обмене ионов Н+ в почве происходит процесс
ПН++ К+ + Cl— → ПК++ Н+ + Cl—. Вытесненный ион Н+ и определяется титрованием. Сделайте выводы. Количественная характеристика ионного обмена в почве впервые изучена К.К.Гедройцем.
ЗАДАНИЕ 7. Определение содержания ионов в пробе питьевой или технической воды в пересчете на анион ОН- Для определения общего количества анионов в исследуемом растворе, в основном, используются аниониты, которые предварительно переводят в ОН- форму. Для этого через предварительно набухшей под водой анионит ЭДЭ-10П, находящийся в ионообменной колонке, пропускают 10 см31 н раствора NaОН. Затем анионит отмывают от не поглощенных ионов ОН- небольшими порциями дистиллированной воды до отрицательной реакции по фенолфталеину. Для проверки на полноту промывания каплю фильтрата помещают на предметное стекло и добавляют к ней одну каплю фенолфталеина. Отсутствие окраски при этом свидетельствует о полноте промывания анионита от ионов ОН-. Во всех случаях пропускания через ионообменную колонку жидкостей над анионитом следует оставлять столбик жидкости 1-1,5 см, иначе в колонке могут образоваться воздушные пузырьки, которые уменьшат ее емкость и затруднят прохождение жидкости через ионит. Испытуемую жидкость (питьевую или техническую воду) в объеме 25 см3 пропускают через подготовленный анионит и промывают его 2-3 раза небольшими порциями дистиллированной воды. Фильтрат и промывные воды собирают в мерную колбу объемом 50 см3. Раствор доводят до метки дистиллированной водой, отбирают 25 см3, добавляют 1-2 капли индикатора (фенолфталеин) и титруют из бюретки 0,01 н раствором кислоты (НCl) до исчезновения малиновой окраски. Титрование повторяют, а данные заносят в табл. 5.10 По среднему значению Vк-ты, пошедшего на титрование, рассчитывают концентрацию ионов ОН- в пробе из выражения:
СН+ *Vк-ты Сон- = ————— 5.17 Vпр Затем рассчитывают содержание ионов ОН- ионов в 25 см3 взятой на анализ воды:
mОН-= СОН _ VФ ЭОН _ 10 -3 г / 25 см3 воды. 5.18
Таблица 5.10. Результаты титрования при анионном обмене
Далее выражают mОН_ на 1 дм3 (1 л) питьевой или технической воды и делают вывод об общем содержании анионов в пробе в пересчете на ОН—ион. На границе раздела раствор сильного электролита и полярное твердое тело (анионит) возникает двойной электрический слой. Ионы внешней обкладки этого слоя, сравнительно слабо связанные с твердой фазой силами электростатического взаимодействия, могут обмениваться с одноименными ионами из раствора в эквивалентных количествах. Процессы ионного обмена на твердой поверхности характеризуются уравнениям Б.П. Никольского (см. ур –ние 5.10). При обмене анионов в пробе с анионитом в ОН- форме происходит процесс, который схематично можно записать:
Cl- │Cl-
CO32- и др │ CO32 и др.
Концентрация ОН- анионов определяется титрованием HCl и будет характеризовать суммарное количество анионов в пробе воды в перерасчете на ион ОН-.
ТЕМА 6.
КОЛЛОИДНЫЕ СИСТЕМЫ
ВВЕДЕНИЕ
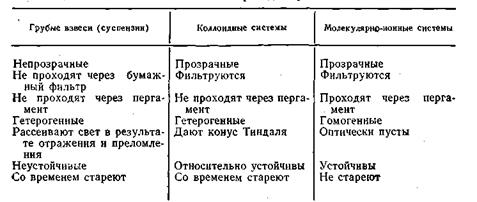
Коллоидная химия изучает физико-химические свойства гетерогенных высокодисперсных систем и высокомолекулярных соединений в твердом состоянии и в растворах. Коллоидная химия — важный самостоятельный раздел физической химии. Коллоидная химия уделяет особое внимание роли поверхностных явлений на границе раздела фаз. В настоящее время коллоидная химия занимается уже не только химическим строением и химическими реакциями, протекающими в коллоидных системах, но и физической структурой, физическими (и даже механическими) свойствами и физико-химическими процессами, характерными для высокодисперсных и высокомолекулярных систем. Вот почему правильнее было бы назвать этот раздел науки более общим термином — физическая химия дисперсных систем. Из курса физической химии известно, что если одно вещество в более или менее раздробленном (дисперсном) состоянии равномерно распределено в массе другого вещества, то систему называют дисперсной. Раздробленное вещество в этом случае называют дисперсной фазой, а среду, в которой оно распределено, — дисперсионной средой. Так, система, представляющая собой взмученную в воде глину, состоит из взвешенных мелких частиц глины — дисперсной фазы и воды — дисперсионной среды. Для характеристики и классификации различных дисперсных Систем в практике широко пользуются понятием степень дисперсности D, которая определяется как величина, обратная величине размера (диаметра) дисперсной частицы a:D=l/a м-1. Отсюда следует, что степень дисперсности есть величина, показывающая, какое число частиц можно уложить вплотную в 1 м. Иногда применяется и другая характеристика степени дисперсности — так называемая удельная поверхность, которая представляет собой отношение поверхности S данного тела к занимаемому объему V, т. е. Sуд.=S/V, где Sуд. — удельная поверхность. С повышением степени дисперсности величина удельной поверхности быстро растет. дисперсные системы по величине частиц дисперсной фазы и по степени дисперсности можно разделить условно на три группы: грубодисперсные, коллоидно-дисперсные и молекулярно (ионно)-дисперсные (табл. 6.1). Дисперсные системы третьей группы, известные под общим названием истинных или молекулярных растворов, всесторонне исследуются в физической химии. Эти системы являются наиболее изученными, так как сравнительно просты по составу и структуре (дискретными единицами в них являются либо простые молекулы, либо ионы), а поведение определяется простыми и четкими
закономерностями. Молекулярно- и ионно-дисперсные системы могут образоваться самопроизвольно; они являются системами равновесными и термодинамически устойчивыми, подчиняющимися правилу фаз. Таблица 6.1
Вторая группа дисперсных систем, получивших название коллоидно-дисперсных, является основным объектом изучения коллоидной химии. Системы этой группы получили название коллоидов или коллоидных систем. Структурной и кинетической единицей в них являются не ион и не молекула в общем смысле, а либо комплекс (агрегат), состоящий из обычных молекул, атомов или ионов, называемых мицеллой, либо макромолекула, т. е. молекула-полимер «гигантских» размеров ~100÷1 нм, обладающая молекулярной или частичной массой в десятки и сотни единиц. С увеличением относительной молекулярной массы в дисперсных системах второй группы можно ожидать новых качественных изменений, т. е. появления новых,более сложных свойств, которые Таблица 6.2
не укладываются в закономерности более простых систем третьей группы. По мере изменения размеров частиц от наиболее крупных (грубодисперсных) к мелким и обратно соответственно изменяются кинетические, оптические, каталитические и другие свойства дисперсных систем. В табл. 6.2 приведены изменения некоторых свойств различных дисперсных систем. Из этой таблицы следует, что коллоидно-дисперсные системы в отличие от истинных растворов сами по себе агрегативно неустойчивы. Размеры их дисперсных частиц могут изменяться как самопроизвольно, так и под влиянием внешних факторов. Одной из причин неустойчивости коллоидных растворов является их гетерогенность. Обладая громадной суммарной поверхностью, следовательно, большой свободной энергией, коллоидные системы согласно второму началу термодинамики стремятся к равновесному состоянию, характеризующемуся разделением системы на две фазы, имеющие минимальные межфазовые поверхности и минимальную свободную поверхностную энергию. |
|
 5.11
5.11 , СР( 2) =
, СР( 2) = 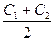 и тд.
и тд. 5.15
5.15 Анионит X OH— +SO42- ® Анионит SO42 + X OH—
Анионит X OH— +SO42- ® Анионит SO42 + X OH—