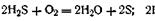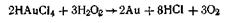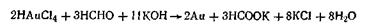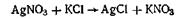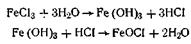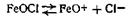|
|
Коллоидные частицы (дисперсная фаза) должны обладать плохой растворимостью в дисперсной среде, хотя бы в момент их получения.При соблюдении этих условий коллоидные частицы приобретают электрический заряд и гидратную оболочку, что препятствует выпадению их в осадок. Дисперсионные методы. Механические методы. Сущность методов механического диспергирования заключается в энергичном и продолжительном растирании, размалывании и прочих механических приемах раздробления вещества. Для этих целей применяются специальные машины, работающие по принципу ударного размельчения и растирания диспергируемых веществ. Наиболее широкое распространение получили шаровые и коллоидные мельницы ( за счет дробления или истирания). Шаровая мельница представляет собой полый цилиндр, в котором находятся стальные или фарфоровые шарики различного диаметра( Рис. 6.1). Измельчение вещества достигается за счет движения шаров, находящихся в цилиндре.
Во всех случаях диспергирование обычно ведут, добавляя соответствующие стабилизирующие вещества, препятствующие слипанию раздробленных частиц. Ультразвуковой метод. Довольно широкое распространение получил метод измельчения веществ с помощью ультразвука.. Ультразвуковые установки отличаются высокой производительностью. С их помощью можно диспергировать самые разнообразные вещества. Метод химического диспергирования. Наиболее распространен метод пептизации. Это процесс перехода из геля в золь под влиянием диспергирующих веществ — пептизаторов. Сущность пептизации заключается в том, что к свежеполученному рыхлому осадку диспергируемого вещества прибавляют небольшое количество пептизатора (чаще всего электролита), который уменьшает взаимодействие между частицами осадка и облегчает их переход в состояние золя. Пептизаторами служат различные электролиты, которые способствуют дезагрегации аморфных осадков. В качестве примера можно назвать получение золя гидроксида железа (III) Fe(OH)3 при действии на его осадок небольшим количеством соли FeCl3, выполняющей роль пептизатора. Практически все рыхлые свежеобразованные осадки гидроксидов металлов, например Аl(ОН)3, Zn(OH)2, подвергаются пептизации. К химическим методам диспергирования относится и так называемый метод самопроизвольного диспергирования. Он заключается в получении коллоидных растворов веществ растворением их в соответствующих растворителях. Так, путем растворения в воде можно получить коллоидные растворы крахмала, желатина, агар-агара и др. Самопроизвольное диспергирование совершается без внешних механических воздействий. Этот метод широко применяется для получения растворов высокомолекулярных веществ из твердых полимеров. Образование коллоидов в природе. В природе активно протекают процессы диспергирования. Приливно-отливные явления океанов и морей, разрушающее действие прибоя, резкие колебания температур, ветер и другие явления природы развивают колоссальные силы, которые дробят горные породы до частиц коллоидных размеров. Постоянное действие ледников и рек также приводит к интенсивным процессам измельчения слагающих пород. Мощным фактором механического диспергирования твердых горных пород является расширение воды при ее замерзании. Проникая глубоко в трещины породы и замерзая там, вода вызывает дробление породы на частицы различного (вплоть до коллоидного) размера. Громадные массы осадочных пород, глины, лесса, которые мы встречаем в природе,— все это результат диспергирования твердых горных пород, которое происходит не только под влиянием механических факторов, но и под влиянием химического воздействия (выветривание под действием диоксида углерода и воды), а также под влиянием биологических факторов. Животные, как и растения, своими выделениями способствуют изменению горных пород. Таким образом, в результате всех перечисленных выше процессов горные породы, подвергаясь глубоким физическим и химическим изменениям, могут образовать сложные коллоидные системы. Конденсационные методы. Большинство конденсационных методов получения коллоидных растворов основано на различных химических реакциях: окисления, восстановления, обменного разложения, гидролиза и др. В результате этих реакций молекулярные или ионные растворы переходят в коллоидные путем перевода растворенных веществ в нерастворимое состояние. В основе методов конденсации, помимо химических процессов, могут лежать и процессы физические, главным образом явления конденсации паров. Рассмотрим кратко наиболее важные методы конденсации (агрегации) частиц до коллоидных размеров. Метод окисления. Он основан на реакциях окисления, в результате которых одно из веществ может быть получено в коллоидном состоянии. Так, при окислении сероводорода кислородом воздуха или двуокисью серы можно получить золь серы:
Эти реакции, как показали исследования, протекают гораздо сложнее, так как наряду с коллоидной серой образуется ряд тионовых кислот. Метод восстановления. Наиболее распространенные химические методы получения коллоидных растворов различных металлов основаны на реакциях восстановления. Ионы, восстанавливаясь, т. е. присоединяя электроны и превращаясь в нейтральные атомы, конденсируются затем в коллоидные частицы. В качестве примера рассмотрим реакцию получения золя золота путем восстановления пероксидом водорода или формалином:
Реакцией восстановления получены в коллоидном состоянии многие металлы: Аu, Ag, Pt, Pd, Rh, Os, Hg и др. Метод обменного разложения. При взаимодействии двух веществ в результате реакции обменного разложения образуется новое труднорастворимое вещество, которое при наличии определенных условий способно находиться в коллоидном состоянии. В качестве примера можно назвать реакцию получения золя сульфата бария
или золя хлорида серебра
Метод гидролиза. Этим методом широко пользуются при получении золей различных металлов из их солей, если в результате реакции гидролиза образуется труднорастворимый гидроксид. Так, например, труднорастворимый гидроксид железа образуется при гидролизе хлорида железа по уравнениям реакций
Образующаяся в результате этих реакций соль железа FeOCl диссоциирует частично на ионы:
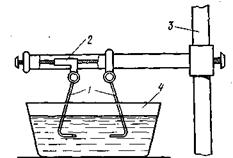
Эти ионы и обеспечивают ионогенный слой вокруг частиц Fe(OH)3, благодаря чему они удерживаются во взвешенном состоянии. Замена растворителя. При замене растворителя вещество, ранее находившееся в растворенном состоянии, выделяется из раствора в виде высокодисперсной фазы, нерастворимой в данном растворителе. Так, если спиртовой раствор канифоли (который представляет собой истинный раствор) небольшими порциями прибавлять в воду, образуется коллоидный раствор канифоли в воде. В данном случае спирт хорошо смешивается с водой, а канифоль очень мало в ней растворяется и поэтому выделяется в виде высокодисперсной фазы. Кроме канифоли этим методом можно приготовлять золи серы, фосфора, мастики и т. п. также путем вливания их спиртовых растворов в воду. Электрический метод. Этот метод, предложенный Бредигом еще в 1898 г., используется преимущественно для приготовления коллоидных растворов благородных металлов. Сущность его заключается в получении электрической дуги между находящимися в воде электродами из золота или платины, серебра и т. д., т. е. из металла, золь которого хотят получить. (Рис. 6.2) показывает схема прибора для получения золей металлов этим способом.
Рис.6.2 |
|
 Для более высокой степени дисперсности, используют специальные коллоидные мельницы. Рис. 6.1.
Для более высокой степени дисперсности, используют специальные коллоидные мельницы. Рис. 6.1.