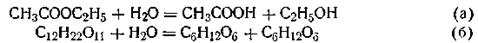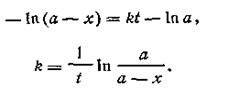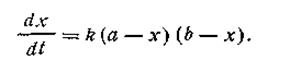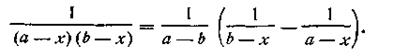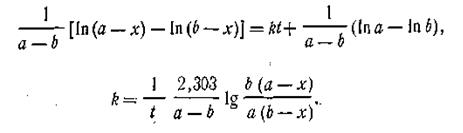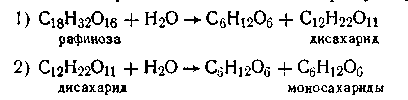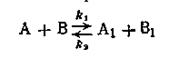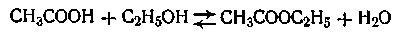|
|
Классификация химических реакций.Все кинетические реакции различают по молекулярности и порядку реакции. Молекулярность реакции определяется числом молекул, участвующих в элементарном акте химического взаимодействия. По этому признаку реакции разделяются на мономолекулярные, бимолекулярные и тримолекулярные. Мономолекулярными называются такие реакции, в которых в элементарном акте взаимодействия участвует одна молекула, например реакции разложения или радиоактивного распада: I2 = 2I Сюда же относятся реакции изомерного превращения сложных молекул в газах и растворах. Примером такой реакции в газовой фазе может служить мономолекулярная реакция распада азометана: CH3N2CH3 = С2Н6 + N2 Бимолекулярными называются реакции, в которых в элементарном акте взаимодействия участвуют две молекулы. Например, реакция образования йодистого водорода: Н2 + I2=2HI или реакция превращения йодистого нитрозила: N0I+ N0I = 2N0 + I2 К этому типу реакций относятся также реакции этерификации сложных эфиров и многие другие. Тримолекулярными называются реакции, в которых в элементарном акте взаимодействия участвуют три молекулы. Например: 2N0 + 02 = 2NO2 Одновременная встреча в элементарном акте взаимодействия трех молекул случается довольно редко. Реакции же более высокой молекулярности вообще неизвестны. В тех случаях, когда из химического уравнения следует, что в реакции участвует большее число молекул, процесс на самом деле происходит более сложным путем — через две и большее число промежуточных стадий моно- или бимолекулярных реакций. Каждому типу реакции отвечает свое кинетическое уравнение, которое выражает зависимость скорости химической реакции от концентрации реагирующих веществ. По форме зависимости υ =f(C) различают реакции первого, второго и третьего порядков. Скорость реакции первого порядка пропорциональна концентрации исходных веществ в первой степени. В реакциях второго и третьего порядков скорость соответственно зависит от концентрации во второй и третьей степени. В общем случае порядком реакции называют сумму показателей степеней, скоторыми концентрацииреагентоввходят в экспериментально найденное кинетическое уравнение. Так, для реакции типа п1А + п2В= n3С + n4D порядок реакции n=n1+ n2. Казалось бы, порядок реакции легко можно определить по виду стехиометрического уравнения. Однако опыт показывает, что порядок, по которому развивается реакция во времени, часто не совпадает с порядком, определяемым по стехиометрическому уравнению. Иными словами, порядок реакции не всегда совпадает с ее молекулярностью. Лишь в наиболее простых случаях наблюдается это совпадение. Реакция может быть бимолекулярной, но протекать по кинетическому уравнению реакции первого порядка и т. п. Примером могут служить реакции гидролиза уксусноэтилового эфира и тростникового сахара в разбавленном водном растворе:
В этих реакциях концентрация воды изменяется ничтожно мало, и скорость реакции зависит только от изменения концентрации эфира (а) или тростникового сахара (б). Поэтому кинетика этих бимолекулярных реакций соответствует уравнению кинетики мономолекулярных реакций. В общем случае, если в реакции одно из веществ находится в большом избытке, порядок реакции, как правило, снижается. Причина несовпадения порядка и молекулярности реакции объясняется тем, что стехиометрическое уравнение реакции описывает процесс в целом и не отражает истинного механизма реакции, протекающей через ряд последовательных стадий.
Реакции первого порядка. К реакциям первого порядка относятся такие, в которых скорость химической реакции связана с концентрацией (С) реагирующих веществ следующим уравнением: υ= kC, или согласно уравнению (2.03)
Если обозначить через а начальную концентрацию вещества до реакции, а через (а—х) концентрацию вещества в конце реакции, где х — число молей вещества, прореагировавшего за время t, и подставить эти значения в уравнение (2.05), получим
Перепишем уравнение (2.06) в таком виде:
Интегрируя уравнение, получим
где const — постоянная интегрирования, которая определяется из условия, что в начале опыта t = 0 и х=0. Подставив эти значения в уравнение (2.08), найдем const = —ln а. Подставляя эту величину в уравнение (2.05), получим:
Перейдя от натуральных логарифмов к десятичным, получим кинетическое уравнение реакции первого порядка в следующем виде:
Константа скорости мономолекулярной реакции показывает долю, которую составляют молекулы, вступившие в реакцию за единицу времени, от общего числа молекул, имеющихся в данный момент. Уравнение (2.10) дает возможность вычислить концентрацию реагирующего вещества в любой момент времени по известной величине константы скорости или найти константу скорости реакции при заданной температуре путем определения концентрации в любой момент времени. Из уравнения (2.10) следует, что размерность константы скорости реакции первого порядка t-l, т. е. 1/с. Скорость реакции первого порядка не зависит от объема (разбавления), в котором протекает реакция. Иными словами, в единицу времени превращению подвергается одна и та же часть вещества. Наряду с константой скорости реакции первого порядка характеризуются также периодом полураспада τ (греч. «тау»), который обозначает время, в течение которого превращается ровно половина взятого количества вещества. Короче говоря, τ есть такой промежуток времени, в течение которого первоначальная концентрация вещества а уменьшается до а/2, т. е. х = а/2. Если подставить в уравнение (2.10) вместо х значение а/2 и вместо t значение τ, получим
Так как lg 2 = 0,301, то
Из уравнения (2.12) следует, что константа скорости реакции первого порядка находится в обратно пропорциональной зависимости от периода полураспада. Реакции второго порядка. К реакциям второго порядка относятся реакции соединения типа A + B→C, реакции обмена A + B = C + D, а также реакции разложения и др. Скорость реакции второго порядка определяется уравнением
где k — константа скорости реакции; а — число молей вещества А в начале реакции; b — число молей вещества В в начале реакции; х—число прореагировавших молей. Здесь возможны два случая. Первый случай — это когда какое-то количество вещества А вступает в реакцию с эквивалентным количеством вещества В, т. е. когда а = b. И второй случай более сложный — это когда а ≠ b. Рассмотрим оба эти случая. Первый случай (а= b).Поскольку исходные концентрации реагирующих веществ равны между собой, уравнение (2.13) примет вид
Разделяя переменные и производя интегрирование, получим
При t = 0 x = 0, откуда const =1/а. После подстановки этой величины в уравнение (2.15) получим
Размерность константы скорости реакции второго порядка t-1C-1. Поэтому в отличие от константы скорости первого порядка численное значение k зависит от того, в каких единицах выражены t и С. Если последняя выражена в кмоль/м3, а время в с, то k имеет размерность [с-1·(кмоль/м3)-1]. Для реакций второго порядка большую роль играет число столкновений, которые происходят в единицу времени между молекулами реагирующих веществ. Число столкновений, в свою очередь, пропорционально числу молекул в единице объема, т. е. концентрации. Таким образом, константа скорости, а следовательно, и скорость реакции второго порядка зависят от разбавления раствора. Второй случай (а ≠ b). Если для реакции взяты неэквивалентные количества реагирующих веществ, скорость реакции выразится так:
После разделения переменных получим это уравнение в другом виде:
Выражение, стоящее в левой части уравнения (2.18), можно представить как
Поcле подстановки этого выражения в уравнение (2.13) получим
После интегрирования
Поскольку при t = 0 х = 0, постоянная интегрирования
Подставляя это выражение в уравнение (2.16), найдем
Это и есть кинетическое уравнение реакции второго порядка. Примером подобной реакции может служить омыление эфиров щелочами: СН3COOC2Н5 + ОН- →СН3COO- + C2Н5ОН Кинетика реакций второго порядка была детально изучена С. Г. Крапивиным еще в 1915 г. Реакции третьего порядка встречаются очень редко и потому не имеет смысла рассматривать математический вывод их кинетического уравнения. Существуют экспериментальные способы определения порядка реакции, основные из них: избыточных концентраций, подстановки в кинетическое уравнение реакций, определение полупериода реакций, графический.
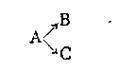
Сложные реакции. Сложными называются реакции, общее кинетическое уравнение которых в отличие от кинетического уравнения простых реакций содержит несколько констант скоростей. К сложным реакциям относятся обратимые, параллельные, последовательные, сопряженные, цепные и другие реакции. Теория всех этих реакций основана на положении, что при протекании в системе одновременно нескольких реакций каждая из них проходит самостоятельно и к каждой из них в отдельности применимы уравнения кинетики простых реакций. Параллельными реакциями называются реакции вида
т. е. при которых одни и те же исходные вещества, одновременно реагируя, образуют разные продукты. Примером подобного типа реакций является реакция разложения бертолетовой соли КСlO3, которая может идти в двух направлениях: Примером последовательных реакций может служить гидролиз рафинозы трисахарида, который происходит через стадии образования дисахарида, а последний образует уже моносахариды:
Расчет кинетики последовательных реакций в общем виде очень сложен и здесь не рассматривается. Отметим только, что если одна из ступеней обладает значительно меньшей скоростью, чем остальные, то общая скорость реакции определяется скоростью именно этой ступени. Сопряженными реакциями называются реакции, которые протекают по следующей схеме: 1)A + В→М 2)A + C→N Реакция 1 может протекать самостоятельно, в то время как реакция 2 проходит при наличии реакции 1. Так, сульфат железа окисляется пероксидом водорода независимо от присутствия йодистого водорода. Последний же в чистом виде пероксидом водорода не окисляется, но при окислении сульфата железа окисляется одновременно с ним. Обратимыми называются такие реакции, скорость которых равна разности между скоростями прямой и обратной реакции:
Примером обратимой реакции, может служить реакция образования сложного эфира
В этом случае скорость прямой реакции с течением времени убывает, а скорость обратной реакции возрастает до тех пор, пока обе скорости не выравняются и не наступит так называемое состояние динамического равновесия. Константа равновесия данной реакции равна отношению констант скоростей прямой и обратной реакции. Наряду с рассмотренными выше реакциями, механизм которых сравнительно прост, существуют также реакции, в которых взаимодействие осуществляется более сложным путем. Примером подобных реакций являются цепные реакции, которые имеют исключительно большое значение в химической технологии, так как на них основаны такие процессы, как полимеризация, крекинг нефти, деление атомного ядра. К цепным реакциям относится большая группа реакций, протекающих путем образования цепи следующих друг за другом реакций, в которых участвуют активные частицы с ненасыщенными свободными валентностями — так называемые свободные радикалы. Свободные радикалы образуются за счет дополнительного поглощения энергии при разрыве связей в молекуле, при электрическом разряде, при поглощении электромагнитных колебаний, а также за счет других внешних источников энергии. Сущность цепного механизма реакции заключается в том, что активная молекула, реагируя, порождает новую активную молекулу или реакционноспособную частицу (валентно-ненасыщенные свободные атомы или радикалы). Процесс исчезновения и регенерации каждой активной частицы в дальнейшем циклически повторяется много раз и создает цепь превращений, совершающихся частью последовательно, а частью параллельно. Впервые определение цепного механизма реакций через образование активных центров было дано Н. А. Шиловым (1904). Чрезвычайно большой вклад в дело изучения цепных реакций внес Н. Н. Семенов, которому за эти исследования была присуждена Нобелевская премия. В настоящее время цепные реакции изучены настолько хорошо, что стало осуществимо регулирование скорости этих реакций. Добавляя вещество, легко вступающее во взаимодействие с активными центрами, можно значительно увеличить число обрывов цепей и тем самым затормозить (или же прекратить вовсе) цепную реакцию. Например, добавление всего лишь 0,01% NС1з (треххлористого азота) к смеси водорода и хлора (Н2 и С2), которые реагируют по типу цепных нарастающих реакций, уменьшает скорость образования хлористого водорода в десятки тысяч раз. Некоторые добавки увеличивают скорость цепных реакций. Так, добавление сравнительно малых количеств N0 в значительной степени ускоряет цепные реакции окисления углеводородов. При этом удается значительно понизить температуру процесса окисления, что очень важно, так как сохраняются от сгорания ценные промежуточные продукты — уксусный и муравьиный альдегиды. На цепных химических реакциях основаны многие технологические процессы — синтез спиртов, кетонов, формалина, уксусной кислоты. В последнее время исследования показали, что некоторые биологические процессы также протекают по типу цепных реакций, в частности процессы биологического окисления.
|
|