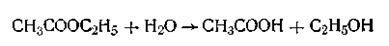|
|
Зависимость скорости реакции от катализатора. Катализ гомогенный и гетерогенный.Скорость химической реакции может регулироваться с помощью катализатора. Вещество, изменяющее скорость химической реакции и остающееся после реакции в неизменном состоянии и количестве, называется катализатором. Изменение скорости химической реакции в присутствии катализаторов получило название катализа. Катализ широко распространен в природе. Сам термин впервые был введен еще в XIV в. С глубокой древности, задолго до создания научных основ химии, человек широко использовал различные каталитические процессы, протекающие с участием биологических катализаторов — ферментов. В качестве примера можно назвать такие процессы, как приготовление алкогольных напитков, сыроварение, выделка кож, хлебопечение и многие другие. Позднее, в конце XVIII — начале XIX в., в химической литературе появляются сведения о том, что ускорение реакции могут вызывать не только биологические, но и другие катализаторы неорганической природы. Катализаторами могут быть самые разнообразные вещества в любом из трех агрегатных состояний: кислоты, соли, основания, оксиды, металлы, различные органические и органоминеральные соединения, газообразные вещества. В ряде случаев каталитическое действие оказывают всевозможные примеси (например, пыль), поверхность стенок сосуда, а также продукты реакции. Если от добавления катализатора к реагирующей смеси скорость химической реакции увеличивается, катализ называют положительным, если же реакция замедляется, то катализ называют отрицательным. Например, добавление двуокиси марганца МnО2 к раствору перекиси водорода Н2О2 резко ускоряет ее разложение, тогда как небольшие количества ацетанилида придают ее концентрированному раствору устойчивость. Иногда катализатор образуется в ходе химического процесса, и такие реакции называются автокаталитическими, а само явление— автокатализом. При автокатализе скорость химической реакции вначале очень мала, но с появлением каталитически действующих продуктов реакции скорость быстро нарастает до известного максимума, после чего снова уменьшается. Это замедление реакции вызвано уменьшением концентрации реагирующих веществ. Примером автокаталитической реакции может служить омыление уксусноэтилового эфира в нейтральном растворе:
В этой реакции катализатором является уксусная кислота, точнее ионы водорода Н+. В ряде случаев присутствие некоторых веществ замедляет или даже практически полностью подавляет действие катализатора. Такие вещества называются соответственно ингибиторами или каталитическими ядами. Так, небольшая примесь окиси углерода отравляет медный катализатор, каталитическое действие платины сильно отравляется селеном и мышьяком, а для железного катализатора такими ядами являются соединения серы (H2S), кислород и его соединения (СО, Н2О и др.). Каталитическая активность смеси различных катализаторов иногда значительно превосходит активность отдельных катализаторов. Например, смесь, состоящая из оксидов железа и висмута (Fe2O3+ Bi2O3), хорошо катализирует окисление аммиака до оксидов азота и широко применяется в производстве азотной кислоты вместо значительно более дорогого катализатора—платины. Каждый из этих оксидов, взятый в отдельности, обладает очень малым каталитическим действием. Увеличение активности катализатора часто наблюдается и при добавлении к катализатору веществ, которые сами по себе являются неактивными. Подобные вещества называются промоторами или активаторами. Так, каталитическая активность никелевого катализатора по отношению к реакции взаимодействия оксида углерода с водородом с образованием метана повышается в сотни раз при добавлении небольших количеств церия, а каталитическая активность V2O5 по отношению к окислению SO2 также повышается во много раз при добавлении небольших количеств щелочи или сульфатов щелочных металлов. В настоящее время смешанные и промотированные катализаторы широко применяются в технике. Механизм воздействия катализатора на химическую реакцию находит объяснение в теории промежуточных соединений. Катализатор с одним из реагирующих веществ образует непрочное промежуточное соединение, которое легко реагирует со вторым компонентом реакции. Это положение подтверждается тем, что в ряде случаев удалось выделить соединения катализатора с одним из компонентов реакции. В общем виде для реакции типа А+В→АВ весь каталитический процесс в присутствии катализатора К можно представить следующими уравнениями: 1) А + К→АК, 2)АК+В→АВ + К Как видим, катализатор образует неустойчивое промежуточное соединение АК. Скорость данной каталитической реакции в конечном счете зависит от того, как быстро образуется и разлагается это промежуточное соединение. Например, если скорость расщепления промежуточного соединения АК на исходные компоненты намного выше, чем превращение промежуточного соединения в конечный продукт, скорость реакции будет мала. И наоборот, если скорость превращения промежуточного соединения в конечный продукт значительно больше скорости его разложения, каталитическая реакция будет протекать очень быстро. Опыт показывает, что подавляющее большинство каталитических процессов протекает со скоростью, имеющей промежуточное значение между этими крайними пределами. Различные каталитические реакции подразделяются на реакции гомогенного и гетерогенного катализа. В тех случаях, когда катализатор и реагирующие вещества образуют однородную систему (т. е. находятся в одной фазе), мы имеем дело с гомогенным катализом. В качестве примеров можно указать на каталитическое окисление СО до СО2 в присутствии паров воды и окисление SO2 до SO3 в присутствии оксида азота NO2. К этому типу каталитических реакций относится и реакция гидролиза растворимых углеводов в водном растворе в присутствии кислоты. Как видим, в первых двух случаях катализатор и катализируемые вещества находятся в газообразном состоянии, в третьем — образуют однородный раствор. Гомогенный катализ в растворах зачастую обусловливается наличием водородных или гидроксид-ионов. Причем с повышением их концентрации увеличивается и скорость реакции. Вполне определенную роль в гомогенном катализе могут играть весьма кратковременные сочетания ионов и молекул, образующиеся под действием ионодипольных сил или в результате возникновения так называемых водородных связей. Благодаря этому происходит поляризация молекул реагирующих веществ и как результат повышение их реакционной способности. При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах, чаще всего катализатором является твердое тело, а реаги- рующие вещества находятся в жидком или газообразном состоянии и реакция протекает на поверхности раздела двух фаз, т. е. на поверхности катализатора. Поэтому гетерогенные каталитические процессы часто называют контактными, а твердые катализаторы — контактными веществами. Опыт показывает, что при гетерогенном катализе большое значение имеют структура, химический состав и величина поверхности катализатора. Так, гладкая платиновая пластинка, опущенная в раствор пероксида водорода, практически не вызывает разложения последнего. Если же поверхность этой пластинки шероховатая, разложение пероксида водорода протекает заметно. Еще больше увеличится скорость разложения, если в качестве катализатора использовать платину в виде порошка. И, наконец, если к раствору пероксида водорода прибавить еще более раздробленную платину в виде ее коллоидного раствора, то разложение Н2О2 произойдет практически мгновенно — в виде взрыва. Как правило, все гетерогенные каталитические реакции (даже относительно простые из них) протекают в несколько стадий: 1) сближение молекул реагирующих веществ, 2) ориентация молекул на активных центрах катализатора, 3) адсорбция молекул реагирующих веществ, сопровождающаяся деформацией связей в молекулах, 4) химическое превращение адсорбированных (и активированных) молекул, 5) десорбция продуктов реакции, 6) удаление этих продуктов с поверхности катализатора. В некоторых случаях роль катализатора могут играть стенки сосуда, в котором происходит химическая реакция. Так, заметное взаимодействие водорода с кислородом в стеклянном сосуде происходит при температуре 623 К, а в платиновом сосуде — при более низкой температуре (288—293 К). В настоящее время каталитические процессы широко используются в промышленности. Сейчас даже трудно назвать крупное производство химической промышленности, где бы не применялись катализаторы. Получение спиртов, альдегидов, аммиака, серной и азотной кислот, переработка каменного угля в жидкое топливо, процессы крекинга нефти при получении моторных топлив, синтез каучука, производство пластмасс, красителей, получение маргарина и других пищевых продуктов — вот далеко не полный перечень процессов, где широко используются катализаторы. В ряде случаев за счет применения катализаторов удается значительно снизить температуру проведения реакции, что позволяет уменьшать тепловые затраты и использовать менее жаростойкую аппаратуру, а также устранять нежелательные побочные реакции. Процессы, в которых катализатор участвует в очень мелкораздробленном состоянии, например в виде частиц коллоидных размеров (менее 10-7м), получили название микрогетерогенного катализа. К этому типу катализа относятся и процессы, протекающие при участии биологических катализаторов — ферментов.
|
|