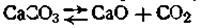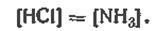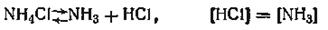|
|
Равновесие в гетерогенных системах. Правило фаз.Принцип Ле Шателье применим не только к гомогенным, но и к гетерогенным системам. В качестве примера рассмотрим гетерогенную химическую реакцию восстановления оксида углерода (IV)
Эта система содержит твердую фазу (уголь) и газообразную (смесь паров СО2 и СО). Поскольку процесс восстановления СО2 идет с поглощением тепла, т.е. является эндотермическим, то согласно принципу Ле Шателье нагревание системы сместит равновесие в сторону увеличения выхода СО, а ее охлаждение будет сдвигать равновесие влево. Изменение давления также окажет существенное влияние на ход этой реакции, так как она в направлении слева направо сопровождается увеличением числа молей газообразной фазы. Повышение давления будет препятствовать протеканию прямого процесса, а уменьшение давления — способствовать ему. Опыт показывает, что если гетерогенная реакция протекает без изменения числа молей газообразной фазы, то изменение общего давления не оказывает влияния на состояние равновесия реакции. В качестве примера можно указать такие реакции:
Закон действующих масс применим к гетерогенным системам лишь с определенными допущениями. Область его приложения ограничена однородными частями равновесной системы. Равновесие же между неоднородными частями системы не подчиняется закону действующих масс. Рассмотрим в качестве примера гетерогенную реакцию диссоциации карбоната кальция при высокой температуре в замкнутом сосуде: В этой системе СаСО3 и СаО находятся в твердом состоянии, а СО2 — в газообразном. Если бы вышеуказанная реакция протекала как гомогенная реакция в газовой фазе (что можно допустить), можно было бы написать
где Однако упругости паров твердых СаСО3 и СаО являются для данной температуры величинами постоянными, поэтому
Подставив это выражение в уравнение (2.42), получим:
Равенство (2.44) показывает, что давление рсо2может иметь только одно определенное значение при данной температуре. Это давление называется давлением диссоциации СаСО3 или упругостью диссоциации. Оно не зависит от концентрации СаСО3 и СаО в данной системе. Опыт показывает, что давление диссоциации для реакции Качественная характеристика гетерогенных равновесных систем, в которых не происходит химического взаимодействия, а наблюдается лишь переход составных частей системы из одного агрегатного состояния в другое, дается правилом Гиббса. Это правило основано на втором законе термодинамики и относится к системам, находящимся в состоянии истинного равновесия. Введем основные понятия : фаза, компонента и степени свободы. Фаза — совокупность частей гетерогенной системы, обладающих одинаковым составом и свойствами и отделенных от других составных частей ограничивающими поверхностями. При переходе через поверхности происходит скачкообразное изменение свойств веществ, образующих данную гетерогенную систему. Фаза может быть простой и смешанной. Простая фаза состоит из одного химически индивидуального вещества (например, бензол в виде эмульсии в воде образует чистую фазу). Смешанная фаза состоит из двух или более химически индивидуальных веществ (например, смеси газов, жидкие и твердые растворы). Любая фаза может представлять собой сплошную массу (например, вода в суспензии глины в воде) или же совокупность более или менее крупных частиц (капельки воды, образующие туман в воздухе, составляют одну фазу). Вещества, которые входят в состав системы и которые могут быть извлечены из системы и существовать вне ее, называются составляющими веществами. Например, водный раствор сахара образован из двух составляющих: воды и сахара. В химических системах некоторые составляющие вещества могут образоваться в результате химического процесса, протекающего в системе. Такие составляющие вещества называются зависимыми. Первоначально же взятые составляющие систему вещества называются независимыми. Компонентами называются независимые составляющие, наименьшего числа которых вполне достаточно, чтобы построить любую фазу в системе, находящейся в равновесии. В физических системах число компонентов равно числу составляющих систему веществ, так как последние не вступают между собой в химическое взаимодействие. В химических же системах число компонентов меньше числа составляющих веществ на число химических уравнений, по которым вещества, образующие систему, обратимо реагируют между собой при данных условиях существования системы. Рассмотрим подсчет числа компонентов на конкретных примерах. Возьмем равновесную гетерогенную систему
Система химическая, составляющих веществ три. Число уравнений химических реакций в системе равно одному. Число компонентов в системе равно 3—1=2. Значит, система эта двухкомпонентная. Другой пример. Рассмотрим систему из трех веществ, в которой между составляющими протекает реакция
т. е. реакция разложения NH4Cl. Оба продукта реакции — NH3 и НСl — находятся в газообразной фазе, и равенство числа образовавшихся молей приводит к уравнению равенства концентраций (в кмоль/м3)
В этом случае мы имеем дело с двумя уравнениями, которыми связаны составляющие вещества:
Таким образом, число компонентов в этой системе будет равно 3—2=1, где 3 — число составляющих веществ, 2 —число уравнений, их связывающих. Как видим, данная система будет однокомпонентной. Число степеней свободы характеризует вариантность системы, т. е. число независимых переменных (давление, температура и концентрация компонентов), которые можно произвольно изменять в некоторых пределах так, что число равновесных фаз в системе остается неизменным. Например, состояние идеального газа характеризуется тремя параметрами: р, V, Т. Из них любая пара является независимыми переменными, характеризующими термодинамическое состояние системы, которое можно изменить произвольно, без нарушения вида и числа фаз в системе. Иными словами, число степеней свободы для идеального газа равно двум, что соответствует двум произвольно заданным параметрам: р и Т; р и С или С и Т, а третий будет определен из уравнения состояния. Другой пример. Равновесная система лед↔вода↔пар существует при строго определенных параметрах: T=273,16 К и р = 610,48 Па. Эта система состоит из трех фаз и одного компонента (вода). Незначительное изменение хотя бы одного из параметров приводит к смещению равновесия в сторону изменения числа фаз системы. Так, повышение температуры будет способствовать переходу воды в пар, в результате чего число фаз уменьшится. К аналогичному нарушению равновесия системы приведет и изменение давления. Таким образом, для рассматриваемой системы степень свободы равна нулю, т. е. нет таких параметров, изменение которых не нарушило бы термодинамического равновесия данной системы. Гиббс (1878) вывел следующее уравнение, выражающее условия фазового равновесия:
где С — число степеней свободы; К — число компонентов; Ф — число фаз в системе. Это соотношение известно как закон равновесия фаз и называется правилом фаз. Правило фаз имеет следующую формулировку: в равновесной многофазной системе число степеней свободы равно числу компонентов плюс два, минус число фаз.
Из уравнения (2.45) можно сделать следующие выводы: 1) чем больше компонентов содержит система (при данном числе фаз), тем больше степень ее свободы; 2) чем большее число фаз находится в равновесии между собой в системе (при данном числе компонентов), тем меньшее число степеней свободы имеет система. Лишенную степеней свободы систему (например, лед — вода — пар) предложено называть инвариантной. Если число степеней свободы С=1, такую систему называют моновариантной, если С=2, то бивариантной, и т. д. В настоящее время правило фаз является критерием равновесного состояния систем и помогает в решении ряда производственных задач, связанных с процессами в химических многофазных системах. Это правило широко применяется в различных областях химии и химической технологии, особенно в металлургии, в производстве различных стройматериалов, пластмасс. Большой вклад в развитие учения о фазовых превращениях был внесен советскими учеными Н. С. Курнаковым, А. И. Цветковым и др.
|
|
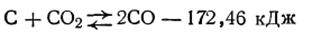

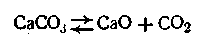

 — упругости паров соответственно СаСО2, СО2 и СаО.
— упругости паров соответственно СаСО2, СО2 и СаО.
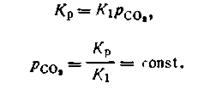
 достигает 0,1 МПа при температуре 1153 К, в то время как при 773 К это давление составляет всего лишь 14,67 Па. Следовательно, при температуре 1153 К начинается интенсивное разложение СаСО3.
достигает 0,1 МПа при температуре 1153 К, в то время как при 773 К это давление составляет всего лишь 14,67 Па. Следовательно, при температуре 1153 К начинается интенсивное разложение СаСО3.