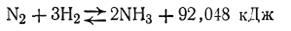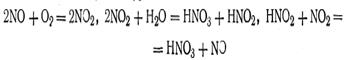|
|
Смещение химического равновесия. Синтез аммиака и получение азотных удобрений.Химическое равновесие является динамическим, т. е. подвижным. При постоянных внешних условиях — концентрация, давление, температура — химическое равновесие сохраняется как угодно долго. Изменение хотя бы одного из указанных факторов немедленно ведет к нарушению равновесия, смещая его в ту или иную сторону. Влияние различных факторов на смещение химического равновесия отражено принципом Ле Шателье (1884). Этот принцип указывает направление смещения равновесия: при изменении в равновесной системе одного из параметров состояния (р, Т, С) происходит сдвиг равновесия в направлении процесса, ведущего к ослаблению произведенного воздействия. Влияние изменения концентрации. В качестве примера рассмотрим, как влияет изменение концентрации, температуры и давления на реакцию синтеза аммиака
Согласно принципу Ле Шателье увеличение концентрации одного из компонентов равновесной химической реакции приводит к сдвигу равновесия в сторону усиления той реакции, при которой происходит химическая переработка этого компонента. И наоборот, уменьшение концентрации одного из компонентов приводит к сдвигу равновесия в сторону образования этого компонента. В рассматриваемом случае увеличение количеств азота или водорода в системе усиливает прямую реакцию, т. е. равновесие смещается вправо, в сторону образования аммиака. С другой стороны, уменьшение, например, азота в этой системе вызовет смещение равновесия в сторону диссоциации аммиака. Влияние температуры. Общее правило, определяющее влияние температуры на химическое равновесие, имеет следующую формулировку: повышение температуры способствует сдвигу равновесия в сторону эндотермической реакции, и наоборот, понижение температуры сдвигает равновесие в сторону экзотермической реакции. Поскольку процесс синтеза аммиака сопровождается выделением тепла, при повышении температуры равновесие сдвигается в направлении справа налево и выход аммиака — конечного продукта реакции — уменьшается. Вот почему в заводских условиях синтез аммиака из водорода и азота стараются вести при наиболее низких температурах. Реакции, протекающие без тепловых эффектов, не смещают своего равновесия при изменении температуры. Повышение температуры в этом случае приводит лишь к более быстрому установлению равновесия, которое было бы достигнуто в данной системе и без нагревания, но за более длительное время. Влияние давления. Как показывает опыт, давление оказывает заметное влияние на смещение только тех равновесных реакций, в которых участвуют газообразные вещества. При увеличении давления равновесие смещается в сторону той реакции, которая сопровождается образованием меньшего количества молей газообразных веществ, а при понижении давления — в сторону образования большего количества молей газообразных веществ. Как видно из уравнения, реакция, идущая в направлении образования аммиака, сопровождается уменьшением объема, так как вместо 4 моль исходных продуктов образуется только 2 моль аммиака. Таким образом, увеличение давления способствует образованию аммиака, а уменьшение давления способствует его разложению. Приложение принципа Ле Шателье к технологическому процессу синтеза аммиака дает возможность выбрать наиболее благоприятные условия осуществления этого процесса, т. е. применение высоких давлений при оптимальных температурах. В табл. 22 показано влияние давления на процентное содержание аммиака в газовой смеси при различных температурах. Из этой таблицы видно, что наиболее благоприятными условиями для выхода аммиака является давление 100 МПа и температура 573 К. Синтез аммиака в заводских условиях осуществляется путем связывания азота воздуха с использованием катализаторов, в качестве которых берется смесь Fe и F2О3 с небольшой добавкой Аl2О3 и КОН, и является очень важным методом промышленного получения азотной кислоты и других азотных соединений. Аммиак хорошо растворяется в воде и в таком виде (аммиачная вода) в настоящее время широко используется в сельском хозяйстве в качестве жидкого азотного удобрения. Промышленность выпускает аммиачную воду двух сортов: первый содержит 25% аммиака (20,5% азота), второй 20% (16% азота). Из аммиака в промышленности получают не только азотную кислоту и ее соли, но и другие соединения азота, которые являются ценными удобрениями. Окисление аммиака в заводских условиях осуществляется в специальных установках с применением в качестве катализатора сплава платины с 5—10% родия. Катализатор изготовляется обычно в виде тонкой сетки, сквозь которую продувается смесь аммиака с воздухом, содержащая примерно 12 об. долей в % аммиака. При этом имеет место следующая химическая реакция: 4NH3 + 5О2 = 4NO + 6H2O Поскольку реакция окисления аммиака является экзотермической, смесь быстро нагревается. Максимальный выход оксида азота составляет около 98% от теоретического. Получение азотной кислоты из оксида азота в дальнейшем сводится к окислению NО до NO2 и растворению последней в воде. Схему процесса можно представить в виде следующих уравнений:
Из азотной кислоты производят наиболее ценное азотное удобрение — аммиачную селитру NH4NO3, содержащую 34—35% азота. В заводских условиях ее получают путем нейтрализации 45—58%-ной азотной кислоты газообразным аммиаком: NH3 + HNO3 = NH4NO3 с последующим упариванием раствора до состояния плава (94,5—98,5% NH4NO3). Далее в зависимости от получаемой марки удобрения соль из плава кристаллизуют или гранулируют. Из аммиака и азотной кислоты получают и другие азотсодержащие удобрения— мочевину CO(NH2)2, сульфат аммония (NH4)2SO4 хлорид аммония NH4C1, кальциевую селитру Ca(NO3)2. Применение азотных удобрений не только имеет решающее значение в повышении урожаев сельскохозяйственных культур на большинстве почв, но и улучшает его качество, увеличивает содержание белка в зерне и кормовых продуктах. Азотные удобрения вносят под все культуры. Особенно эффективно применение азотных удобрений в сочетании с другими минеральными удобрениями — фосфорными и калийными.
|
|