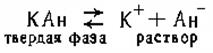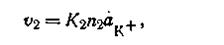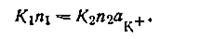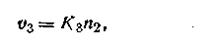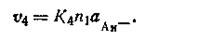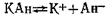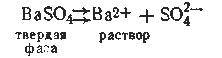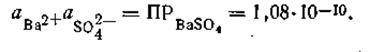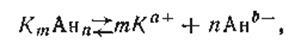|
|
Применение закона действующих масс к равновесным системам «раствор — осадок». Правило произведения растворимости.Системы, содержащие жидкую и твердую фазы — «раствор — осадок», имеют исключительно важное значение в аналитической химии, почвоведении и геологии. Раствор, концентрация которого при соприкосновении его с твердой фазой увеличивается, т. е. скорость растворения превышает скорость кристаллизации, а состояние динамического равновесия еще не наступило, является ненасыщенным. Если раствор находится в равновесии с твердой фазой растворенного вещества, он является насыщенным. Таким образом, между раствором и осадком в состоянии насыщения имеет место динамическое равновесие: в единицу времени в раствор переходит такое же количество вещества, которое выделяется из раствора. Предположим, имеется насыщенный раствор малорастворимой соли КАн, которая в растворе полностью распадается на ионы. В результате между твердой фазой (КА) и ионами (К+ и А-) устанавливается равновесие
Обозначим через п1— число катионов (К+), через n2 — число анионов (Ан-), приходящихся на единицу поверхности твердой фазы. Скорость υ1, с которой катионы будут переходить в раствор, пропорциональна числу катионов, находящихся на поверхности осадка, т.е.
где К1— коэффициент, постоянный при данной температуре. В это же время будет идти обратный процесс — осаждение катионов на поверхности твердой фазы. Чем больше анионов на единице поверхности твердой фазы, тем больше будет осаждаться катионов. Количество осажденных катионов будет зависеть также и от концентрации их в растворе. Таким образом, скорость осаждения катионов (υ2)прямо пропорциональна числу анионов, находящихся на этой поверхности, и активности катионов (ак+) в растворе, т. е.
где K2— коэффициент, постоянный при данной температуре. При растворении твердой фазы число катионов, переходящих враствор, постепенно уменьшается, а число катионов, отлагающихся на поверхности твердой фазы, увеличивается. Наконец, наступает такой момент, когда скорость перехода катионов в раствор равна скорости осаждения их на поверхности твердой фазы, т. е. υ1 = υ2, следовательно,
Рассуждая так, получим следующие выражения скоростей подобных процессов по отношению к анионам: скорость перехода анионов в раствор
скорость осаждения анионов из раствора на поверхности твердой фазы
Таккак при наступлении равновесия
Перемножив левые и правые части равенств (2.49) и (2.51) между собой, получим
Произведение концентраций, точнее активностей, ионов труднорастворимого электролита в его насыщенном растворе при постоянной температуре есть величина постоянная. Это произведение активностей ионов называется произведением растворимости (ПР), а сформулированное выше свойство насыщенного раствора труднорастворимого электролита — правилом произведения растворимости. Например, в насыщенном растворе сульфата бария наблюдается следующее равновесие:
Произведение растворимости BaSO4
Если какой-либо труднорастворимый электролит диссоциирует с образованием двух или нескольких одинаковых ионов, например
где m и п — соответственно число катионов и анионов, образованных из одной частицы электролита, а+ и b- — валентности катиона и аниона, то выражение произведения активностей ионов примет вид
Иными словами, при вычислении значения произведения растворимости активность каждого из ионов должна быть возведена в степень, равную числу одинаковых ионов, образующихся при распаде одной частицы. В табл. 24 приведены произведения растворимости некоторых малорастворимых соединений. Таким образом, в случае гетерогенных равновесных систем выпадение осадка начнется тогда, когда произведение активностей его ионов, находящихся в растворе, превысит величину произведения растворимости данного вещества, т. е. aK + ∙ aАн- > ПРКАн, Зная произведение растворимости какого-либо электролита, можно найти его растворимость не только в воде, но и в растворе, содержащем одноименный ион. Одним из способов, повышающих полноту осаждения иона, является прибавление некоторого избытка осаждающего реактива. Поскольку произведение активностей иона в насыщенном растворе малорастворимого электролита есть величина постоянная, увеличение концентрации одного из ионов приводит к более полному удалению из раствора в осадок другого иона. Например, прибавление ионов Ва2+ к насыщенному раствору BaSO4 приводит к уменьшению концентрации другого иона SO42- , т. е. к образованию твердой фазы. Количество BaSO4 в растворе уменьшится. Однако произведение активностей ионов а( Ва 2+ )∙а( SО4 2- ), находящихся в растворе, останется неизменным и будет равно произведению растворимости сульфата бария.
|
|