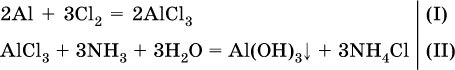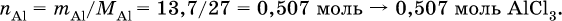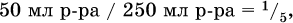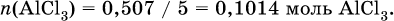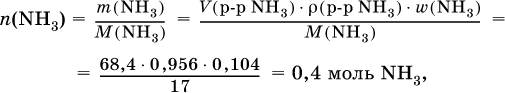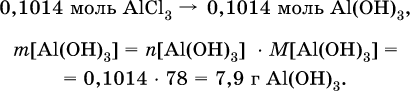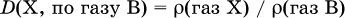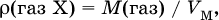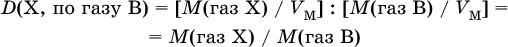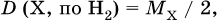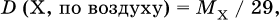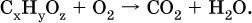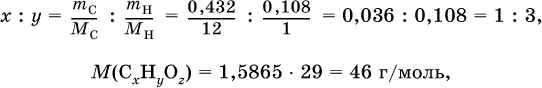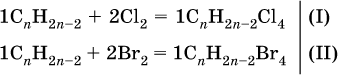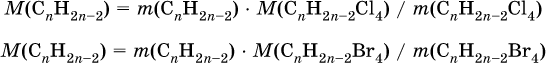|
|
Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе
Пример решения задачи
Навеску алюминия массой 13,7 г полностью сожгли в хлоре, а из образовавшейся соли приготовили 250 мл раствора. Пробу в 50 мл этого раствора слили с 68,4 мл 10,4 %‑ного раствора аммиака (плотность раствора 0,956 г/мл). Определите массу (в граммах) выпавшего осадка. Элементы ответа. 1) Составлены уравнения реакций:
2) Определены количества AlCl3 в реакциях (I) и (II): в реакции (I)
в реакции (II) взята 1/5 часть AlCl3, т. к.
отсюда
3) Определено количество NH3 в растворе для реакции (II):
следовательно, NH3 – в избытке, и расчет далее ведется по AlCl3. 4) Определена масса Al(ОН)3 по уравнению (II): 0,1014 моль AlCl3 – 0,1014 моль Al(ОН)3,
Задания для самостоятельного решения частей В, С
1. Приготовили раствор 134,4 л (н.у.) диоксида серы и добавили 1,5 л 25 %‑ного раствора гидроксида натрия (плотность раствора 1,28 г/мл). Определите массу (в граммах) образовавшейся соли. 2. Сульфид свинца (II) массой 95,6 г обрабатывают с помощью 300 мл 30 %‑ного раствора пероксида водорода (плотность раствора 1122,2 г/л). Рассчитайте массу (в граммах) продукта – сульфата свинца (II). 3. Смешали 100 г 5,64 %‑ного раствора фенола и 100 г 17,92 %‑ного раствора гидроксида калия. Найдите массовую долю (в %) избытка одного из реагентов в конечном растворе. 4. Установите массу (в граммах) железной пластинки после выдерживания в 110 мл 10 %‑го раствора CuSO4 (плотность раствора 1,1 г/мл), если до опыта ее масса составляла 11,5 г. 5. Вычислите объем (в литрах) 96 %‑ного водного спирта с плотностью 0,81 кг/л, полученного каталитической гидратацией 112 м3 (н.у.) этилена, содержащего 12,5 % (по объему) этана. 6. Газ, полученный сжиганием 44,8 л (н.у.) сероводорода в кислороде, поглощен с помощью 0,5 л 25 %‑ного раствора гидроксида натрия (плотность раствора 1,275 г/ мл). Определите массовую долю (в %) соли в конечном растворе. 7. Углекислый газ объемом 15 л (н.у.) пропущен через 560 г 5%‑ного раствора гидроксида калия. Найдите массу (в граммах) соли, полученной в этом процессе. 8. Железная пластинка массой 5 г опущена на некоторое время в 50 мл 15 %‑ного раствора сульфата меди (II) с плотностью 1,12 г/мл. Масса пластинки увеличилась на 0,16 г. Какова массовая доля (в %) сульфата меди (II) в оставшемся растворе? 9. По реакции Кучерова получен этаналь, который переведен в соответствующую кислоту в виде 100 г 6%‑ного водного раствора. Найдите объем (в литрах, н.у.) исходного органического соединения в получении этаналя. 10. Определите массовую долю (в %) избытка одного из реагентов в растворе после сливания 80 г 10 %‑ного раствора гидроксида натрия и 2O г 18,25 %‑ной хлороводородной кислоты. 11. Установите объем (в литрах, н.у.) газа, собранного после внесения 0,3 моль алюминия в 160 мл 20 %‑ного раствора гидроксида калия (плотность раствора 1,19 г/мл). 12. Найдите массу (в граммах) органического продукта, полученного при смешивании 250 г 94 % – ного водного раствора фенола и 2143 г 3,5 %‑ной бромной воды.
Нахождение молекулярной формулы органического соединения
При выведении формул веществ, особенно в органической химии, часто используют относительную плотность газа. Относительная плотность газа X – отношение абсолютной плотности этого (неизвестного) газа к абсолютной плотности другого (известного) газа В при одинаковых условиях:
Для 1 моль газа его абсолютная плотность равна
откуда
Если газ В задан, то – плотность газа X по водороду Н2 (М = 2 г/моль)
– плотность газа X по воздуху (М = 29 г/моль)
и аналогично для любого другого известного газа X.
Примеры решения задач
1. В результате сгорания кислородсодержащего органического соединения в избытке воздуха собрано 1,584 г СO2 и O,972 мл Н2O. Плотность пара этого соединения по воздуху равна 1,5865. Выведите формулу соединения, если в его молекуле содержатся два одноименных радикала. Элементы ответа. 1) Составлена схема реакции:
2) Определена масса С и Н в этом соединении:
3) Определена формула соединения CxНyOz:
при х = 1 и у = 3: М(СН3) = 15, 46–15 = 31 г/моль на кислород – это не подходит, при х = 2 и у = 6: 2М(СН3) = 30, М0 = 16, 30 + 16 = = 46 г/моль – это подходит, таким образом, искомая формула соединения С2Н6O, или с учетом условия (СН3)2O. 2. Некоторая масса неизвестного алкина с избытком хлора дает 21 г тетрахлор‑производного. Такая же масса того же алкина с избытком брома – 38,8 г тетрабром‑производного. Выведите формулу взятого алкина. Элементы ответа. 1) Составлены уравнения реакций:
2) Составлены выражения для молярных масс производных:
и для молярной массы алкина:
3) Выведена формула алкина: по условию масса алкина одинакова в реакциях (I) и (II), следовательно
откуда n = 5 и формула алкина С5Н8.
Задания для самостоятельного решения части С
1. При сжигании углеводорода (плотность по воздуху равна 2) в кислороде образовалось 90 г воды. Выведите формулу углеводорода. 2. Гомолог этена массой 7 г присоединяет 2,24 л (н.у.) бромоводорода. Какова формула этого гомолога? 3. Выведите формулу некоторого углеводорода, если при сжигании в кислороде он образовал 6,6 г углекислого газа и 2,16 мл воды. 4. При полном сгорании некоторого арена в кислороде собрано 7,168 л (н.у.) углекислого газа. Выведите формулу этого углеводорода. 5. Выведите формулу одноатомного спирта, если при взаимодействии 27,6 г этого спирта с бромоводородом (в присутствии серной кислоты) получено 65,4 г бромалкана. 6. При сжигании 1,64 г органического соединения в избытке кислорода получено 1,06 г карбоната натрия, 1,12 л (н.у.) углекислого газа и 1,26 мл воды. Выведите формулу этого соединения. 7. Выведите формулу двухатомного спирта, при взаимодействии 9,3 г которого с кальцием собрано 3,36 л (н.у.) газа. 8. К 14 г смеси фенола и 0,05 моль гомолога бензола добавили бромную воду и получили 33,1 г осадка. Выведите формулу гомолога бензола. 9. После сжигания в кислороде навески соединения класса фенолов образуются 16,8 л (н.у.) углекислого газа и 6,75 мл воды. Выведите формулу этого соединения (плотность по воздуху 3,793). 10. В реакции «серебряного зеркала» с участием 9,9 г альдегида выпадает 48,6 г осадка. Выведите формулу альдегида. 11. При взаимодействии 71,15 мл 30 %‑ного раствора одноосновной карбоновой кислоты (плотность раствора 1,04 г/мл) с избытком гидрокарбоната натрия выделилось 6,72 л (н.у.) газа. Выведите формулу этой кислоты. 12. При сжигании на воздухе 3,84 г соли одноосновной карбоновой кислоты получено 2,24 л (н.у.) углекислого газа, 1,8 мл воды и 2,12 г карбоната натрия. Выведите формулу этой соли. 13. Соль серебра (I) и одноосновной карбоновой кислоты обработана избытком хлора. Образовались монохлорпроизводное углеводорода, углекислый газ и осадок хлорида серебра (I). Плотность пара хлорпроизводного по воздуху равна 3,19. Выведите формулу исходной соли. 14. Одноосновная карбоновая кислота полностью прореагировала с 3,2 мл метанола (плотность 0,8 г/мл) и дала 8,16 г органического продукта. Какова формула этого продукта? 15. Выведите формулу этилового эфира одноосновной карбоновой кислоты, если при омылении 14,8 г этого эфира с помощью едкого натра получено 9,2 г этанола. 16. При сжигании 13,5 г кислородсодержащего органического соединения образовалось 19,8 г углекислого газа и 8,1 мл воды. При этом выделилось 210 кДж теплоты. Выведите формулу соединения, если тепловой эффект реакции 2800 кДж. 17. При полном сгорании 22,5 г некоторой α‑аминокислоты в кислороде собрано 13,44 л (н.у.) углекислого газа и 3,36 л (н.у.) азота. Выведите формулу кислоты. 18. После щелочного гидролиза метилового эфира природной моноаминокарбоновой кислоты получено 200 г раствора, в котором массовые доли спирта и натриевой соли аминокислоты равны соответственно 3,2 % и 11,1 %. Выведите формулу исходного эфира.
Ответы
Раздел 1
1. 2. 2. 2. 3. 3. 4. 3. 5. 2. 6. 3. 7. 3.
Раздел 2
1. 3. 2. 2. 3. 2. 4. 4. 5. 3. 6. 1. 7. 2. 8. 1. 9. 4. 10. 2. 11. 3. 12. 2. 13. 2. 14. А‑2, Б‑4, В‑6, Г‑3.
Раздел 3
1. 4. 2. 4. 3. 3.4. 2. 5. 1, 4. 6. 2, 4. 7. 2. 8. 3. 9. 3. 10. 3. 11. 4. 12. 1.13. 2.
Раздел 4
1. 1, 4. 2. 4. 3. 4. 4. 2. 5. 3. 6. 2. 7. 2. 8. 3. 9. 2. 10. 4. 11. 2. 12.3.13. 1. 14. 4. 15. 1. 16. 4.17. 1. 18. 1, 4. 19.3. 20. А‑4, Б‑2, В‑5, Г‑3. 21. А‑3, Б‑5, В‑4, Г‑1. 22. 2.23. См. разделы 6.3, 7.3.2, 7.3.4. 24. См. разделы 4, 5.3, 6.3, 7.4.2.
Раздел 5
1. 1. 2. 2, 4. 3. 2, 4. 4. 3. 5. 1, 3.6. 3. 7. 2. 8. 4. 9. 2.
Раздел 6
1. 3. 2. 4. 3. 2. 4. 2, 4. 5. 1, 2. 6. 3. 7. 2. 8. 3.9. 2. 10. 4. 11. 2. 12. 3. 13. 3. 14. 4. 15. 1, 2. 16. 2. 17. 1.
Раздел 7
1. 2. 2. 4. 3. 2. 4. 1. 5. 4. 6. 4. 7. 1, 4.8. 2. 9. 3. 10. 4. 11. 4. 12. 1. 13. 3. 14. 2. 15. 1. 16. 4. 17. 2. 18. 1. 19. 4. 20. 4. 21. 1. 22. 2.
Раздел 8
1. 2. 2. 4. 3. 3. 4. 4. 5. 4. 6. 3. 7. 2. 8. 1.9. 2. 10. 4. 11. 2, 3. 12. 2. 13. 3. 14. 1. 15. 2. 16. 2. 17. 3. 18. 1. 19. 4. 20. 2, 4. 21. 2, 3. 22. 2. 23. 4.24. 2. 25. 1. 26. А‑3, Б‑6, В‑4, Г‑1. 27. А‑3, Б‑5, В‑4, Г‑2.
Раздел 9
1. 3. 2. 4. 3. 2. 4. 4. 5. 2. 6. 1. 7. 4.8. 2, 4. 9. 1. 10. 3. 11. 4. 12. 2. 13. 3. 14. 2. 15. 1, 2, 3. 16. 3. 17. 2. 18. 4. 19. 1. 20. 4, 3, 1. 21. 1. 22. 4. 23. 4. 24. А‑5, Б‑1, В‑6, Г‑3. 25. 4. 26. 1, 4. 27. 3. 28. 1. 29. 2.
Раздел 10
1. 1. 2. 4. 3. 3. 4. 2. 5. 2. 6. 1, 2, 3. 7. 1, 3, 4. 8. 3. 9. 2. 10. 1. 11. 2. 12. 3, 4. 13. 4. 14. 2. 15. 4. 16. 1. 17. 3. 18. 4. 19. 1, 3. 20. 3. 21. 2. 22. 4. 23. 4. 24. 2, 4. 25. 1, 2, 3. 26. 1, 3. 27. 1, 3. 28. 1, 2, 4.29. 1. 30. 1, 2, 3. 31. 2. 32. 1. 33. 2, 1, 4. 34. 2, 4, 5. 35. 3, 4, 5. 36. 3.
Раздел 11
1. 2. 2. 3. 3. 2, 3, 4. 4. 3. 5. 2. 6. 3. 7. 1. 8. 4. 9. 2. 10. 3. 11. 3. 12. 4. 13. 3. 14. 3. 15. А‑5, Б‑4, В‑6, Г‑1. 16. 1, 4. 17. 2, 3. Подсказки к ответу: 18. X1 – СН3СН(ОН)СН3, Х2 – CH3CH(ONa)CH3, Х3 – СН3СН(ОН)СН3; 19. X1 – С2Н4, X2 – С2Н5ОН, X3 – СН3СООСН3; 20. Х1 – C3H6, Х2– С3Н7Br, Х3 – С3Н7ОН; 21. – C6H5NO2, Х2 – C6H5NH2, Х3 – [C6H5NH3]Cl, Х4– NH2C6H4NO2.
Раздел 12
1. 2, 3. 2. 3. 3. 4. 4. 1. 5. 4. 6. 3. 7. 2, 3. 8. 1, 4. 9. 1. 10. 4. 11. 4. 12. 2.
Раздел 13
1. 4. 2. 2. 3. 3. 4. 3. 5. 2.6. 4. 7. 1. 8. 3. 9. 4. 10. 2. 11. 3. 12. 2. 13. 1. 14. 2. 15. 3. 16. 4. 17. 4. 18. 4. 19. 3. 20. 3. 21. 3. 22. 1. 23. 4. 24. 4. 25. 2. 26. 1. 27. 3. 28. 3. 29. 2. 30. 3. 31. 1. 32. 4. 33. 2. 34. 2. 35. 3. 36. 1. 37. 3. 38. 3, 4. 39. А‑3, Б‑2, В‑4, Г‑1. 40. А‑3, Б‑1, В‑3, Г‑2. 41. А‑4, Б‑3, В‑4, Г‑1.
Раздел 14
1. 3. 2. 1. 3. 4. 4. 1. 5. 3. 6. 4. 7. А‑3, Б‑5, В‑2, Г‑1. 8. 3. 9. 1. 10. А‑4, Б‑3, В‑6, Г‑4. 11. А‑4, Б‑6, В‑2, Г‑6. 12. 2Mn(NO3)2 + 6HNO3 + 5РЬO2 = 2HMnO4 + 5Pb(NO3)2 + 2H2O. Окислитель РЬO2, восстановитель Mn(NO3)2. 13. 3Zn + 3H2SO4 + 2HNO3 (разб.) = 3ZnSO4 + 2NO + 4H2O. Окислитель HNO3, восстановитель Zn. 14. K2Cr2O7 + 8HCl + 3C2H5OH = 2CrCl3 + 3CH3C(H)O + 7H2O + 2KCl. Окислитель K2Cr2O7, восстановитель C2H5OH.
Раздел 15 15.1.
1. 13,9 % КCl. 2. 291 г С2Н5ОН. 3. 160 л НС(Н)O. 4. 14,8 % ZnSO4. 5. 25 г CuSO4 5Н2O. 6. 0,231 л НBr. 7. 468 г Н2O. 8. 75 г раствора KNO3. 9. 4,42 л раствора К(СН3СОО). 10. 1,376 л Н2O. 11. 56,7 % СН3ОН. 12. 0,14 моль AgNO3. 13. 74,41 л NH3. 14. 25 % NaNO3. 15. 39,47 г H2SO4 (конц.). 16. 35,6 % СН3ОН. 17. 0,163 % НCl. 18. 499 л Н2O. 19. 9,11 % СаCl2. 20. 16,61 моль КОН. 21. 279,4 мл Н2O. 22. 46,67 моль Н2O. 23. 46,77 мл СН3СООН (конц.). 24. 9,09 % Cl2Н22О11. 25. 196,92 г NaOH. 26. 8,8 % НCl. 27.9,1 % Sr(NO3)2.
15.2.
1. 1. 2. 3. 3. 3. 4. 2. 5. 2.6. 2. 7. 4.8. 1. 9. 4. 10. 3.
15.3.
1. 4,48 л Н2. 2. Кальций Са. 3. 3,36 л Н2. 4. Медь Cu. 5. Железо Fe. 6. Серебро Ag. 7. 17,8 г (4,8 г Mg + 13 г Zn). 8. 6,18 л Cl2. 9. 22,4 л HF. 10. 9,6 г S.11. 42,83 г Bi2S3.12. 240 г CsOH. 13. 16,8 л (13,44 л NO2 + 3,36 л O2). 14. 735 г Н3РO4. 15. 134,4 л (89,6 л NH3 + 44,8 л СO2). 16. 22,4 л Н2. 17. 268,8 л Cl2. 18. 21,2 моль С2Н5Br (продукт – С4Н10). 19. 224 мл С2Н2 (продукт – С2Н2Br4). 20. 33,6 л Н2. 21. 230 мл С2Н5ОН. 22. 224 м3 Н2. 23. 224 л СO2. 24. 750 мг NH2CH2COOH (глицин).
15.4.
1. 1. 2. 2. 3. 1. 4. 1. 5. 4. 6. 3. 7. 2.8. 3. 9. 1. 10. 2.
15.5.
1. 8,44 г AgCl. 2. 6,72 л H2S. 3. 11,2 л Cl2. 4. 1,6 % NaCl. 5. 89,6 л НCl. 6. 72 % CuО. 7. 34,03 кг технического Al. 8. 13,44 л NH3. 9. 90 % NaNO3. 10. 8,4 % NaHCO3. 11. 2,24 л СO2. 12. 15,4 % Cl7Н35СООН.
15.6.
1. 756 г Na2SO3. 2. 121,2 г PbSO4. 3. 8,05 % КОН. 4. 12 г. 5. 248,5 л раствора С2Н5ОН. 6. 32,9 % Na2SO3. 7. 50 г КНСO3. 8. 9,48 % CuSO4. 9. 2,24 л С2Н2. 10. 4 % NaOH. 11. 10,08 л Н2. 12. 155,2 г С6Н2Br3ОН.
15.7.
1. С4Н10. 2. С5Н10. 3. С5Н8. 4. C6H5C2H5. 5. C2H5OH. 6. Na(C3H7O). 7. C2H4(OH)2, или CH2(OH) – CH2(OH). 8. C6H5CH3. 9. C6H4(OH)2. 10. CH3C(H)O. 11. C2H5COOH. 12. Na(C2H5COO). 13. Ag(C4H9COO). 14. C3H7C0 °CH3. 15. HCOOC2H5. 16. C6H12O6. 17. NH2CH2COOH. 18. CH3CH(NH2)COOCH3.
[1]Буквой α (альфа) обозначают степень протекания любых обратимых реакций, в том числе и степень гидролиза солей (см. 13.5)
|
|