|
|
Термодинамика химического равновесия.Время установления равновесия зависти от скорости реакции. Скорость реакции измеряется по изменению одной из концентраций веществ реакции за единицу времени
или
Производная берется со знаком минус, если с – концентрация исходного вещества (убывает), и со знаком плюс, если с – концентрация продукта реакции (возрастает). Скорость химической реакции зависит от природы и концентрации реагирующих веществ, температуры, наличия катализатора или ингибитора. Зависимость скорости химической реакции от концентрации определяется законом действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях стехиометрических коэффициентов. Скорость химической реакции, как правило, сильно зависит от температуры. Существует эмпирическое правило Вант – Гоффа, согласно которому при повышении температуры на 10°С скорость реакции возрастает в 2-4 раза. Число, показывающее во сколько раз увеличивается скорость химической реакции при повышении температуры, называют температурным коэффициентом скорости реакции и обозначают γ:
k2 = k1
Изменение температуры равновесной системы, концентрации ее составных частей, а в некоторых случаях и внешнего давления приводит к нарушению равновесия. Направленное изменение концентраций, обусловленное внешним воздействием и проявляющееся в том, что одни концентрации уменьшаются, а другие увеличиваются, называют смещением равновесия. Направление, в котором происходит смещение равновесия при изменении температуры, можно определить, руководствуясь правилом Вант – Гоффа: повышение температуры вызывает смещение равновесия в сторону реакции, идущей с поглощением теплоты, а понижение температуры смещает равновесие в сторону реакции, идущей с выделением теплоты.
Пример №10 Куда будет смещаться равновесие при изменении температуры для системы 2NO2 = N2O4 ∆Hр = -57 кДж/моль? Решение. В соответствии с правилом Вант – Гоффа равновесие для реакции, идущей с выделением теплоты, смещается влево при увеличении температуры и вправо – при ее уменьшении. Правило Вант – Гоффа можно пояснить с позиций термодинамики и с позиций кинетики химических реакций. С позиции кинетики рассуждения ведут следующим образом. Энергии активации для прямой и обратной обратимых реакций различны: Еакт.обр = Еакт. прям + 57 кДж/моль, т.еЕакт.обр.>Еакт.прям.. Температурный коэффициент скорости тем больше, чем больше энергия активации. Следовательно, при увеличении температуры константа скорости обратной реакции увеличится больше, чем константа скорости прямой. Поэтому при увеличении температуры равновесие смещается влево. С позиции термодинамики к этому выводу можно прийти по - другому. Константа равновесия системы выражается:
K =
Сомножитель, зависящий от энтропии, при изменении температуры практически не изменяется. При увеличении температуры сомножитель, зависящий от энтальпии, уменьшается, так как ∆H< 0, а температура находится в знаменателе показателя степени. Следовательно, при увеличении температуры константа равновесия станет меньше, а так как выражение константы равновесия имеет вид
то уменьшение константы равновесия является следствием того, часть N2O4перейдет в NO2, т.е равновесие сместится влево. Правило Вант – Гоффа является частным случаем принципа Ле – Шателье: если находящуюся в равновесии систему подвергнуть внешнему воздействию (изменить температуру, концентрацию или внешнее давление), то в системе происходит изменение, уменьшающие внешнее воздействие.
Пример № 11 Вычислите среднюю скорость реакции, если начальная концентрация исходных веществ 6 моль/л, а через 2 мин. 2 моль/л. Решение. Ответ: средняя скорость реакции 2 моль/л·мин.
Пример № 12 Константа скрости реакции (CH3CO)2O + H2O = 2CH3COOHпри 15°С равна 0,0454 мин-1. Исходная концентрация уксусного ангидрида была равна 0,5 моль/л. Чему будет равна скорость реакции в тот момент, когда концентрация уксусной кислоты станет равной 0,1 моль/л? Решение. Учитывая что вода в избытке, кинетическое уравнение для данной реакции: V = K·c((CH3CO)2O) По уравнению: 1 моль (CH3CO)2O 2 моль CH3COOH По условию: 0,05 моль (CH3CO)2O 0,1 моль CH3COOH Следовательно, c((CH3CO)2O) = 0,5 – 0,05 = 0,45 моль/л. Константа скорости реакции от концентрации реагентов не зависит, поэтому Vреакции = 0,0454 · 0,45 = 0,0204 моль/л·мин. Ответ: скорость реакции в момент когда (CH3CO)2O = 0,1 моль /л, составит 0,0204 моль/л·мин. Пример № 13 Как изменится скорость прямой реакции 2CO(г) + O2(г) = 2CO2(г) при увеличении концентрации СО в 3 раза? Решение. V1 = K · c2(CO) · c(O2); V2 = K · (3c2)(CO) · c(O2);
Ответ: скорость реакции увеличится в 9 раз.
Пример№ 14 Константа скорости распада пенициллина при 36°С равна 6 · 10-6 сек-1, а при 41°С 1,2 · 10-5 сек-1. Вычислить температурный коэффициент реакции. Решение. По правилу Вант – Гоффа k2 = k1 Ответ: температурный коэффициент реакции равен 4.
Пример № 15 Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергия активации уменьшается на 4 кДж/моль? Решение.
Ответ: скорость реакции увеличится в 5 раз.
Задачи для самостоятельного решения. 1) Вычислить температурный коэффициент константы скорости реакции разложения пероксида водорода в температурном интервале 25 - 55°С при Ea = 75,4 кДж/моль. (2,53). 2) При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий 192. Рассчитайте, какая часть введенного радионуклида останется в опухоли через 10 сут. (91%). 3) Какая доля (%) новокаина разложится за 10 сут. его хранения при 293 К, если константа скорости гидролиза новокаина при 313 К равна 1 · 10-5 сут-1, а энергия активации равна 55,2 кДж/моль. 4) При аварии на АЭС появляется изотоп йода 131I, период полураспада которого 8 сут. За какое время этот изотоп распадается на 99%? 5) В системе 2NO(г) + O2(г) = 2NO2(г) равновесные концентрации веществ составляют NO = 0,2 моль/л, O2 = 0,3 моль/л, NO2 = 0,4 моль/л. Рассчитать константу равновесия и оценить положение равновесия. 6) Обратима ли практически реакция гидролиза глицин – глицина при 310 К, если ∆G°реакции = -15,08 кДж/моль? 7) Вычислить константу равновесия образования метилового спирта CO(г) + 2H2(г) = CH3OH(г) при с.у. Сделать заключение о практической обратимости реакции при с.у. 8) Рассчитать константу равновесия реакции окисления этанола в уксусный альдегид при 310 К. 9) Химическая реакция при 10°С заканчивается за 16 мин. При какой температуре она закончится за 1 мин при температурном коэффициенте = 2. (50°С). 10) Как изменится скорость прямой реакции 2NO(г) + O2(г) = 2NO2(г) при увеличении давления в 2 раза? (увеличится в 8 раз).
|
|
 ±= Vср
±= Vср = Vср
= Vср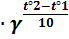
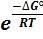 =
= 

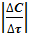 =Vср;
=Vср;  =2 моль/л·мин
=2 моль/л·мин =
= 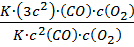 = 9
= 9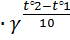 ; k2 = k1
; k2 = k1 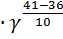 =
= 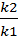 =
=  = 2; γ0,5; γ = 4
= 2; γ0,5; γ = 4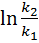 =
=  =
=  = 1,61;
= 1,61;  = 5,03
= 5,03