|
|
Электролитическая диссоциация в растворахПри растворении в воде или других растворителях кислоты, основания и соли подвергаются электролитической диссоциации, полностью или частично распадаясь на ионы. Отношение числа продиссоциированных молекул к числу растворенных называют степенью диссоциации. В зависимости от величины степени диссоциации электролиты делятся на сильные и слабые. Сильные электролиты диссоциируют полностью на ионы, т.е имеют степень диссоциации равную единице. Слабые электролиты диссоциируют частично. Уравнение диссоциации сильных электролитов представляют диссоциацию как необратимый процесс
HCl NaOH
Малорастворимые соли относятся к сильным электролитам. В растворе они диссоциируют практически нацело. Однако процесс растворения и диссоциации в этом случае обратимый – обратимая реакция происходит на границе раздела твердого вещества и раствора. Константы равновесия, описывающие процесс растворения малорастворимых солей, называют произведениями растворимости:
BaSO4 (тв)
Слабые электролиты диссоциируют обратимо, при этом обычно степень диссоциации бывает небольшой и значительная часть слабого электролита существует в недиссоциированном состоянии. Константы равновесия, описывающие диссоциацию слабых электролитов, называют константами диссоциации: HClO
Слабые многоосновные кислоты диссоциируют ступенчато, степень диссоциации первой и второй ступени различаются количественно:
H2S HS-
Слабые основания – гидроксиды металлов – тоже диссоциируют ступенчато. Также малорастворимые гидроксиды характеризуются и произведениями растворимости. Вода является слабым электролитом, ее электролитическая диссоциация описывается уравнением
H2O
Вследствие малой степени диссоциации концентрацию недиссоциированных молекул можно принять равной общей концентрацией воды (сH2O = 1000/18) и общую концентрацию воды как величину постоянную в разбавленных растворах объединить с концентрацией равновесия
Таким образом, в воде и разбавленных водных растворах произведение концентрации ионов водорода на концентрацию гироксид-ионов есть величина постоянная, при 25°С равная 10-14. Это произведение называют ионным произведение воды и обозначают Kw. Концентрацию ионов водорода и гироксид-ионов в этом произведении выражают в моль/л. В химии принято концентрации ионов водорода и гироксид-ионов выражать в логарифмических единицах, в виде так называемых водородного показателя pH и гидроксильного показателя pOH.
Логарифмируя равенство рН + рОН = 14 Пример № 1 Рассчитайте рН и рОН 10-3 М раствора хлороводородной кислоты. Решение. Хлороводородная кислота является сильным электролитом; следовательно, [H+]=10-3 моль/л, а
Ответ: рН = 3, рОН = 11.
Пример № 2 Рассчитайте концентрацию ионов водорода с рН = 7,42 Решение.
Ответ: рН = 3,8 ∙ 10-8 моль/л
Пример № 3 Вычислите рН уксусной кислоты с концентрацией равной 0,04 моль/лрКа (CH3COOH) = 4,76рКа = -lgКд. Решение. CH3COOH– слабый электролит, диссоциирует частично, поэтому с(CH3COOH) не равна c(H+). Для расчета рН в растворах слабых электролитов используется формула:
Ответ: рН = 3,08
Пример № 4 Рассчитайте рН в 5% растворе муравьиной кислоты, если степень ее диссоциации равна 0,01%, а плотность раствора составляет 1,012 г/мл. Решение. Муравьиная кислота слабая и диссоциирует обратимо: HCOOH = H+ + COO-, поэтому расчет рН ведем с учетом степени ее диссоциации
Ответ: рН = 3,96
Пример № 5 В результате гидролиза гидрокарбоната натрия в его растворе создается слабощелочная среда. Рассчитайте рН раствора, содержащего 10 г гидрокарбоната натрия в 200 мл раствора, если степень гидролиза равна 0,01%. Решение. 1. Гидролиз солей процесс обратимый; NaHCO3+ HOH = NaOH + H2O + CO2 HCO3- + HOH = OH- + CO2 + H2O В результате гидролиза образуются ОН- ионы , т.е среда в растворе щелочная. 2. Концентрация ОН-ионов определяется по формуле с(ОН-) = h ∙ c(NaHCO3), где h– степень гидролиза соли, а c(NaHCO3) – молярная концентрация гидрокарбоната в растворе
с(ОН-) = 0,0001 ∙ 0,59 = 5,9 ∙ 10 – 5 моль/л; 3. 4. рН + рОН = 14; рН = 14 – 4,22 = 9,78 Ответ: рН = 9,78 |
|
 H+ + Cl-
H+ + Cl- Ba2+(р) + SO42-(р);ПРBaSO4 = [Ba2+][SO42-]
Ba2+(р) + SO42-(р);ПРBaSO4 = [Ba2+][SO42-] H+ + ClO-;
H+ + ClO-;  = 5
= 5 
 = 8,9
= 8,9 
 = 1,3
= 1,3 
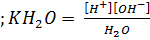 = 1,8
= 1,8 
 =
= 


 =
=  =
=  моль/л;
моль/л; = -lg 10-3 = 3;
= -lg 10-3 = 3; = -lg 10-11 = 11.
= -lg 10-11 = 11. = 10-рН = 10-7,42 = 3,8 ∙ 10-8 моль/л.
= 10-рН = 10-7,42 = 3,8 ∙ 10-8 моль/л.
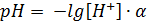 ;
;  α – степень диссоциации
α – степень диссоциации =
= 
 = 0,59 моль/л;
= 0,59 моль/л; = -lg5,9 ∙ 10 – 5 = 4,22
= -lg5,9 ∙ 10 – 5 = 4,22