|
|
Сутність та формулювання першого закону термодинамікиПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ Основні поняття хімічної термодинаміки Хімічна термодинаміка – це розділ фізичної хімії, що вивчає закони взаємних перетворень різних видів енергії, стани рівноваги та їх залежність від чинників, а також можливість, напрямок і межу протікання самодовільних процесів. Термодинаміка розглядає різні проблеми за допомогою математичного апарата і спирається при цьому на три вихідні положення – основні закони (начала), що, в свою чергу, засновані на сукупності багатовікового досвіду. Справедливість цих законів підтверджується тим, що жоден з їх наслідків не суперечить досліду. Перший закон термодинаміки – це закон еквівалентності енергії. Від дає можливість виражати різні види енергії деякими еквівалентними величинами. Другий закон термодинаміки є законом про напрямок процесу. Від дозволяє передбачити, чи пройде процес за даних умов у певному напрямку, а також підібрати оптимальні умови проведення процесу. Третій закон термодинаміки – це закон про абсолютне значення ентропії. Він дозволяє проводити розрахунки хімічних рівноваг без їх експериментального відтворення. У розв'язанні тих чи інших питань термодинаміка використовує свій особливий –термодинамічний(феноменологічний) метод. Сутність цього методу полягає в узагальненні дослідних даних з подальшим використанням одержаних висновків (у вигляді законів) без урахування детальної будови розглядаємих систем. Особливістю термодинамічного методу є придатність його лише до систем, що складаються з дуже великої кількості окремих частинок (тобто метод має статистичний характер), а також можливість визначення лише імовірності розглядаємих процесів. Питання швидкості процесу термодинамічним методом визначити неможливо. Не зважаючи на свою обмеженість, термодинамічний метод більш точний, ніж статистичний та квантово-механічний методи дослідження, бо при його застосуванні не треба уводити спрощуючі припущення, які необхідні через складність реальних систем, вивчаємих методами статистичної чи квантової механіки. Визначимо основні поняття хімічної термодинаміки – систему, стан системи і процес. Предметом дослідження термодинаміки є система. Система – це тіло або сукупність взаємозв'язаних тіл, які можна фізично або в уяві виділити з навколишнього середовища. Термодинамічною вважається система, що складається з великої кількості частинок – такої, щоб в системі мала місце дифузія і теплопередача. Термодинамічна система – це модель реального об'єкта дослідження, що відображає найбільш суттєві для термодинаміки якісні і кількісні ознаки. Система, що не може обмінюватися з навколишнім середовищем енергією і речовиною, називається ізольованою. Система, що обмінюється з навколишнім середовищем лише енергією, називається закритою. Якщо ж система обмінюється з навколишнім середовищем і енергією і речовиною, то вона вважається відкритою. Гомогенною називають систему, в середині якої відсутні поверхні поділу, що відокремлюють частини системи з різними властивостями. Якщо в системі є поверхні поділу, що відокремлюють частини системи з різними властивостями, така система є гетерогенною. Системи, в яких протікають лише оборотні процеси, вважають рівноважними. Системи, в яких проходять лише необоротні процеси, називають нерівноважними. Кожна термодинамічна система визначається сукупністю властивостей, які кількісно виражаються деякими числовими значеннями. Всі ці властивості можуть бути розділені на дві групи. Одні з них – екстенсивні – залежать від маси речовин, з яких складається система, і при процесі сумуються (об'єм, ентропія, ентальпія, внутрішня енергія, теплоємкість тощо). Інші ж не залежать від маси системи і мають однакові значення в усіх точках системи, якщо вона знаходиться в стані рівноваги. Ці властивості, особливо важливі для термодинамічного опису, називаються інтенсивними. До них належать тиск, температура тощо. Інтенсивні властивості при процесі вирівнюються. Властивості, які однозначно визначаються станом системи, називаються параметрами стану системи. Параметр стану характеризує будь-яку властивість системи і не залежить від того, як система прийшла до цього стану. Основними параметрами системи вважають ті, які безпосередньо вимірюються на досліді. Це тиск, температура і об'єм. Для вимірювання температури в системі СІ прийнято термодинамічну температурну шкалу з одиницею кельвін (К). Позначається температура буквою Т. Для визначення практичних результатів температури допускається застосування міжнародної практичної температурної шкали з одиницею градус Цельсія (°С). За цією шкалою температура позначається буквою t. Співвідношення між цими величинами визначається рівнянням Т,К = t°С + 273,15 » t°С + 273. Тиск в системі СІ позначається буквою Р, одиниця вимірювання – паскаль (Па). 1 фіз.атм.(атм.) = 1,013×105 Па = 760,00 мм рт. ст. Об'єм в системі СІ позначається буквою V, одиниця вимірювання – кубічний метр (м3). Процесомназивається зміна стану системи (зміна хоча б одного з параметрів стану). Термодинамічні процеси можна характеризувати за різними ознаками. Так, наприклад, розрізняють ізотермічні (Т = const), ізобарні (P = const), ізохорні (V = const), ізобарно-ізотермічні (Р.Т = const) процеси. В залежності від виділення чи поглинання теплоти процеси називають відповідно екзотермічними або ендотермічними. Якщо система не обмінюється з навколишнім середовищем теплотою, процес називають адіабатичним. Циклічним вважають процес, внаслідок якого система повертається в початковий стан (усі параметри стану приймають вихідні значення).
Сутність та формулювання першого закону термодинаміки
Перший закон термодинаміки є кількісним формулюванням закону збереження енергії в застосуванні до процесів, що пов'язані з перетворенням теплоти в роботу. Ще в працях М.Ломоносова (1748р.) дане загальне положення принципу збереження руху (енергії), що безпосередньо зв'язано зі змістом першого закону термодинаміки. В обгрунтуванні закону важливу роль відіграли праці Гесса, Майера, Джоуля, Гельмгольца та інших видатних вчених. Існує декілька формулювань першого закону термодинаміки. Основними з них є такі: - енергія ізольованої системи стала; - різні форми енергії переходять одна в іншу в строго еквівалентних співвідношеннях; - неможливо створити вічний двигун (perpetum modile) першого роду, який давав би можливість одержувати роботу, не витрачаючи на це енергії. Як узагальнення всіх формулювань першого закону термодинаміки виступає рівняння
яке є наслідком сталості запасу внутрішньої енергії ізольованої системи: в будь-якому процесі збільшення внутрішньої енергії системи (DU) дорівнює кількості теплоти (Q), що поглинається системою, мінус кількість роботи (W), яку виконала при цьому система. В системі СІ за одиницю вимірювання теплоти, роботи і внутрішньої енергії беруть джоуль (Дж). Інколи в фізико-хімічних розрахунках користуються калоріями (кал). Співвідношення між джоулем і калорією має вигляд: 1 кал = 4,184 Дж. Розглянемо фізичний зміст величин рівняння (1.1). U – внутрішня енергія системи. Це повний запас енергії нерухомої системи, на яку не діють зовнішні сили (тиск). Внутрішня енергія системи складається з енергії поступального та обертального руху молекул, енергії коливання атомів, енергії обертання електронів тощо. Розглядаючи принцип еквівалентності теплоти і роботи, відкритий Джоулем (1840-1845), стосовно до кругового (циклічного) процесу, одержуємо
З рівняння випливає, що величина dU є повним диференціалом внутрішньої енергії системи. Величина, диференціал якої є повним диференціалом змінних станів, називається функцією стану системи. Попередній вираз можна переписати у вигляді
Таким чином, внутрішня енергія системи є однозначною, безперервною і кінцевою функцією стану системи. Розбиваючи інтеграл в попередньому рівнянні на два інтеграли по шляху від стану 1 до стану 2 і навпаки – від стану 2 до стану 1, маємо:
Останній вираз вказує на те, що зміна внутрішньої енергії при переході її з одного стану в інший не залежить від шляху процесу, а залежить тільки від початкового і кінцевого стану системи. За будь-яку температуру (і при 0 К) внутрішня енергія системи більше нуля. При підвищенні температури внутрішня енергія системи зростає, а при фазових перетвореннях (наприклад, плавлення або кипіння) – зростає стрибкоподібно. При сталій температурі внутрішня енергія системи постійна. Зміна внутрішньої енергії системи відбувається в результаті енергообміну між системою і навколишнім середовищем. Існує дві основні форми енергообміну – теплота і робота. У разі, коли енергія передається шляхом хаотичного руху частинок тіла, говорять про передачу теплоти. Мірою енергії, що передається шляхом неупорядкованогоруху часток системи, є кількість теплоти (Q). У термодинаміці величина Q вважається додатною, якщо теплота поглинається системою, і від'ємною, якщо теплота виділяється системою (правило знаків). У випадках, коли енергія передається шляхом упорядкованого руху частинок системи, вважають, що відбувається робота. Мірою цієї форми передачі енергії є кількість роботи (W). У загальному випадку робота може бути представлена у вигляді суми декількох різних елементарних робіт – роботи розширення чи стиснення (об'ємна робота), хімічної роботи, роботи руху електричного заряду в електричному полі, роботи проти гравітаційних чи магнітних сил тощо. У кожному конкретному випадку слід визначати, які види робіт мають місце в досліджуваній системі і використовувати їх в рівнянні (1.1). Для багатьох металургійних систем і процесів має практичне значення лише об'ємна робота (Wоб), яка може бути визначена за рівнянням
Сума інших видів робіт називається корисною роботою і позначається W'. Тоді маємо W = Wоб + W'. Корисна робота для основних металургійних процесів, не пов'язаних з електрохімічними джерелами енергії, звичайно приймається рівною нулю (W' = 0). У термодинаміці роботу вважають додатною, якщо система виконує роботу, і від'ємною, якщо робота виконується над системою. В рівнянні (1.1) тільки внутрішня енергія є функцією стану системи і її диференціал має властивості повного диференціалу. На відміну від внутрішньої енергії, поняття теплоти і роботи відносяться не до системи, а до процесів. Теплота і робота не є функціями стану системи, вони залежать від шляху процесу і їх диференціали не є повними диференціалами. Тому перший закон термодинаміки в диференціальній формі для нескінченно малих процесів має вигляд
де dQ і dW –нескінченно малі зміни теплоти і роботи при процесі.
1.3. Застосування першого закону термодинаміки до важливіших термодинамічних процесів
При застосуванні першого закону термодинаміки до найбільш поширених процесів користуються деякими законами ідеальних газів. До реальних газів ці закони можуть застосовуватись лише за певних умов. Головними причинами, що викликають відхилення властивостей реальних газів від властивостей ідеального газу, є наявність у них власного об'єму і взаємного притягання між молекулами, що не враховується при виведенні законів ідеального газу. Взаємне притягання (взаємодія) молекул посилюється із зменшенням відстані між ними. При цьому зростає також частка простору, яку займають самі молекули газу. Таким чином, при зменшенні об'єму, який займає газ (внаслідок підвищення тиску або зниження температури), будь-який реальний газ буде давати все більші відхилення від властивостей ідеального газу. І навпаки, при достатньому зниженні тиску або підвищенні температури реальний газ знаходиться у стані, коли закони ідеальних газів можна застосовувати до нього з будь-яким ступенем точності. Більшість металургійних процесів відбуваються при низькому і сталому тиску та високих температурах. Тому до них можна застосовувати закони ідеальних газів. Розглянемо ізохорний процес (V = const).Згідно з першим законом термодинаміки (1.1):
Тобто при сталому об'ємі поглинена системою теплота витрачається на збільшення внутрішньої енергії системи. При ізобарному процесі (Р = const):
Тобто при сталому тиску поглинена системою теплота витрачається на збільшення внутрішньої енергії системи і виконання об'ємної роботи. Опрацюємо рівняння (1.5) таким чином:
Оскільки U – функція стану системи, а Р і V – параметри стану, то сума U + PV є також функцією стану системи. Ця функція називається ентальпією і позначається символом Н. Визначенням величини Н служить тотожність
Рівняння (1.6) свідчить про те, що при сталому тиску поглинена системою теплота витрачається на збільшення ентальпії системи. Ентальпія системи - це повний запас енергії нерухомої системи, на яку діють зовнішні сили (тиск). Оскільки Н – функція стану системи, то її зміна (DН) не залежить від шляху процесу, а залежить лише від початкового і кінцевого стану системи. Вимірюється ентальпія у джоулях (Дж). За будь-яку температуру ентальпія системи додатна (Н > 0). Із зростанням температури ентальпія збільшується, а при фазових перетвореннях – збільшується стрибкоподібно. При сталій температурі ентальпія постійна. При сталому тиску зміна ентальпії визначається рівнянням
а співвідношення між теплотами ізобарного і ізохорного процесів – рівнянням
У багатьох випадках зміна ентальпії може бути легко виміряна експериментально, що робить цю функцію дуже важливою в термодинамічних дослідженнях металургійних процесів, оскільки більшість з них протікають при сталому тиску. Абсолютне значення ентальпії не може бути розраховане за допомогою рівнянь термодинаміки, бо воно включає абсолютне значення внутрішньої енергії, яке виміряти не можна. Для ізотермічного процесу (Т = const),використавши рівняння Менделєєва-Клапейрона
одержуємо
і, враховуючи, що при сталій температурі DU = 0, маємо
де n – число моль речовини; Т – температура, К; V1 і V2 – початковий і кінцевий об'єми системи, м3; R – універсальна газова стала, Дж/(моль×К). Стала R дійсно є універсальною газовою сталою, оскільки вона не залежить від жодних факторів. Чисельне значення її легко визначається за допомогою рівняння (1.10). Якщо виражати величини рівняння в системі СІ, то значення універсальної газової сталої дорівнюватиме 8,314 Дж/(моль×К). Фізичний зміст газової сталої можна визначити, якщо рівняння (1.10) написати одного разу для температури Т, а іншого разу для Т + 1, обидва рази для одного моль речовини і однакового тиску. Віднімаючи перше рівняння від другого і позначаючи зміну об'єму через DV, одержуємо R = PDV. Тобто універсальна газова стала дорівнює роботі розширення 1 моль газу при підвищенні температури на 1 К при сталому тиску. Число моль речовини (n) можна визначити за рівнянням
де m – маса речовини, кг; М – молярна (мольна) маса речовини, кг/моль. При ізобарно-ізотермічному процесі (Р, Т = const),виразивши V1 і V2 з рівняння Менделєєва-Клапейрона (1.10):
одержимо
де Dn – зміна числа моль газоподібних речовин при протіканні процесу (реакції). Наприклад, для реакцій: С(Т) + О2 = СО2 Dn = 1 моль СО2 – 1 моль О2 = 0; СаСО3(Т) = СаО(Т) + СО2 Dn = 1. Перехід речовини з одного агрегатного стану в інший при сталих тиску і температурі супроводиться виконанням роботи, яку можна визначити за рівнянням
де n – число моль речовини; DV – зміна мольного об'єму речовини при переході з одного стану в інший, м3; Р – тиск, Па. Якщо рідина перетворюється в пару при сталих температурі і тиску, причому тиск дорівнює тиску її насиченої пари, то роботу можна визначити рівнянням
де n – число моль речовини; R – універсальна газова стала, Дж/(моль×К); Т – температура випаровування рідини, К.
Задача 1.1.Визначити Wоб і DН при плавленні 5,585 кг заліза при тиску 1,013×105 Па і температурі плавлення 1812 К, якщо зміна об'єму системи при плавленні становить 5×10-7 м3/моль. Теплота плавлення заліза (Qпл) за цих умов дорівнює 15,49 кДж/моль. Розв'язання. Плавлення заліза при сталому тиску супроводиться збільшенням ентальпії, яке можна визначити за рівнянням (1.6)
Робота, виконана системою при плавленні 5,585 кг заліза, дорівнюватиме
Задача 1.2.20 кг доменного газу, взятого при тиску 1,013×105 Па, стискають ізотермічно (Т = 350 К) до об'єму 6,00 м3. Мольна маса газу складає 52×10-3 кг/моль. Визначити теплоту, роботу і кінцевий об'єм газу. Розв'язання. При ізотермічному процесі DU = 0, а
Початковий об'єм газу знайдемо з рівняння Менделєєва-Клапейрона
а кінцевий тиск – з рівняння закону Бойля-Маріотта
Тоді
|
|
 , (1.1)
, (1.1) .
. .
.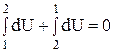 ;
; .
.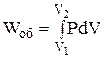 . (1.2)
. (1.2) , (1.3)
, (1.3) при W' = 0;
при W' = 0; ; dV = 0; Wоб. = 0.
; dV = 0; Wоб. = 0. . (1.4)
. (1.4) ;
; . (1.5)
. (1.5) ;
;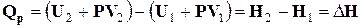 ;
; . (1.6)
. (1.6) . (1.7)
. (1.7) , (1.8)
, (1.8) . (1.9)
. (1.9) ,(1.10)
,(1.10)
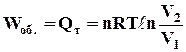 , (1.11)
, (1.11) , (1.12)
, (1.12) і
і  ,
,
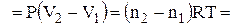
 , (1.13)
, (1.13) ,
, ,
, кДж.
кДж. Дж.
Дж. .
. м3,
м3, Па.
Па. Дж = -682,44 кДж.
Дж = -682,44 кДж.