|
|
Залежність теплових ефектів реакцій від температури.Закон Кірхгофа Здебільшого металургійні процеси проводяться не при кімнатній (298 К), а при значно вищих температурах, оскільки реакції окислення-відновлення і розкладу при низьких температурах протікають дуже повільно. Тому стає задача визначати теплові ефекти реакцій при будь-яких температурах. Це можна зробити за законом Кірхгофа. Вивід закону проведемо, використавши реакцію відновлення заліза з оксидів воднем Fe2O3 + 3H2 = 2Fe + 3H2O. Як вище вказувалось, тепловий ефект реакції – це зміна ентальпії системи у ході реакції. Тому
Візьмемо диференціал рівняння по температурі при сталому тиску і, пам'ятуючи рівняння (2.5), одержимо:
або
де DСр,і - зміна теплоємкості у ході реакції, яку можна визначити за рівнянням DСр,і = ånіСр,кін.,і - ånіСр,поч.,і . Рівняння (3.5) є законом Кірхгофа в диференціальній формі: температурний коефіцієнт ізобарного теплового ефекту реакції Аналіз рівняння (3.5) свідчить про складну залежність теплового ефекту реакції від температури. Дійсно, при DСр,і > 0 і величина При зміні температури теплоємкості реагуючих речовин змінюються не однаково, тому можливі випадки, коли для реакції при одних температурах DСр,і > 0, а при других - DСр,і < 0 і навпаки. У цьому разі залежність теплового ефекту від температури описується кривими, наведеними на рис. 3.1. Закон Кірхгофа в диференціальній формі дозволяє лише якісно оцінити вплив температури на тепловий ефект реакції. Щоб мати змогу кількісно обчислювати теплові ефекти при будь-яких температурах, треба проінтегрувати рівняння (3.5) в межах температур від Т1 до Т2:
Рис. 3.1. Залежність теплового ефекту реакції від температури в умовах зміни знаку величини åniCp,i
Рівняння (3.6) відоме як закон Кірхгофа в інтегральній формі: тепловий ефект реакції при будь-якій температурі (Т2) дорівнює тепловому ефекту цієї реакції при певній температурі (Т1), плюс інтеграл Кірхгофа. На практиці найчастіше беруть Т1 = 298 К, бо стандартні теплові ефекти багатьох реакцій відомі, а при потребі їх можна визначити за законом Гесса. Тому закон Кірхгофа можна представити рівнянням
Розв'язати інтеграл Кірхгофа можна двома методами. Перший метод полягає в використанні емпіричного ступеневого ряду теплоємкості
де Dа, Dв, Dс і Dс' – зміна коефіцієнтів емпіричного ступеневого ряду у ході реакції, яку можна визначити за рівнянням:
При обчисленні інтегралу Кірхгофа за другим методом користуються функціями тепловмісту реагуючих речовин
де
Якщо в інтервалі температур від 298 до Т К є фазові перетворення, обчислення теплового ефекту треба вести за рівнянням (3.9), в якому всі можливі фазові перетворення враховані. При користуванні рівнянням (3.8) необхідно врахувати теплоти фазових перетворень, а також зміну теплоємкості речовини, що при цьому відбувається. У цьому випадку рівняння (3.8) набуває вигляду
Задача 3.1. Визначити теплові ефекти реакції (Х) Х. Fe3O4 + 4CO = 3Fe + 4CO2, що має місце при виплавці чавуну у доменному процесі, при 298 і 1000 К. Зробити висновки про вплив температури на тепловий ефект реакції. Розв'язання. Стандартний тепловий ефект реакції визначимо шляхом алгебраїчного підсумовування допоміжних реакцій, які підбираємо, користуючись табл. Д.3 і правилами, наведеними на стор. 26:
ІІ. FeO + CO = Fe + CO2 +3 Перевірка. Підсумовуючи допоміжні рівняння за (3.3), одержуємо Fe3O4 + CO + 3FeO + 3CO = 3FeO + CO2 + 3Fe + 3CO2. Після скорочення і об'єднання однакових речовин, маємо рівняння Fe3O4 + CO = 3Fe + CO2, що відповідає базовому рівнянню (Х). Перевірка позитивна. Тепловий ефект визначаємо за рівнянням (3.4)
Оскільки Тепловий ефект при 1000 К визначимо за рівнянням (3.8)
DН1000 < 0, отже реакція і при 1000 К проходить з виділенням теплоти (екзотермічна). При зростанні температури від 298 до 1000 К тепловий ефект реакції зменшується від –14,79 до –62,30 кДж.
Задача 3.2.Визначити тепловий ефект реакції Fe3O4 + 4CО = 3Fe + 4CO2 при 1100 К. Відомо, що при 1033 К залізо з a-форми переходить в b-форму і теплота переходу (Qпер.) становить 2,76 кДж/моль. Роз'язання. Тепловий ефект реакції визначаємо за рівнянням (3.11), яке в цьому випадку має вигляд
Візьмемо Dа, Dв і Dс' до перетворення заліза з попередньої задачі, а після перетворення – розрахуємо по аналогії: Dа = 3×37,68+4×44,14-86,27-4×28,41 = 77,69 Дж/К; Dв = 10-3(3×0+4×9,04-208,92-4×4,10) = -189,16 Дж/К2; Dс' = 105[3×0+4×(-8,54)-0-4×(-0,46)] = -32,32×105 Дж×К.
Задача 3.3. Марганець одержують відновленням його оксидів алюмінієм. Реакція природнього MnO2 з алюмінієм проходить дуже бурхливо, тому MnO2 поперед прожарюють до Mn2O3, який реагує з алюмінієм більш спокійно 3Mn3O4 + 8Al = 9Mn + 4Al2O3. Визначити теплові ефекти реакції при 298 і 1000 К. Зробити висновок про вплив температури на тепловий ефект реакції. Розв'язання. Стандартний тепловий ефект реакції визначимо за рівнянням (3.2), взявши
Тепловий ефект при 1000 К знайдемо за рівнянням (3.9), скориставшись даними табл. Д.4.
Таким чином, реакція відновлення марганцю протікає з виділенням теплоти і при 298, і при 1000 К, тобто є екзотермічною. З підвищенням температури тепловий ефект реакції дещо збільшується.
ДРУГИЙ ЗАКОН ТЕРМОДИНАМІКИ
|
|
 .
.
 , (3.5)
, (3.5) дорівнює зміні ізобарної теплоємкості реакції.
дорівнює зміні ізобарної теплоємкості реакції. >0, тобто з ростом температури тепловий ефект реакції збільшується. Якщо DСр,і < 0, то і
>0, тобто з ростом температури тепловий ефект реакції збільшується. Якщо DСр,і < 0, то і  . У цьому випадку температура на тепловий ефект реакції не впливає.
. У цьому випадку температура на тепловий ефект реакції не впливає.
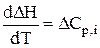 ; dDH = DCр,і × dT;
; dDH = DCр,і × dT;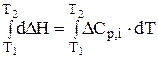 ;
; . (3.6)
. (3.6)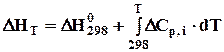 . (3.7)
. (3.7)

 , (3.8)
, (3.8) ;
;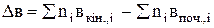 і т.д.
і т.д. , (3.9)
, (3.9)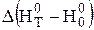 і
і  - зміна функцій тепловмісту у ході реакції, яку можна визначити за рівняннями:
- зміна функцій тепловмісту у ході реакції, яку можна визначити за рівняннями: ;
; . (3.10)
. (3.10) (3.11)
(3.11) І. Fe3O4 + CО = 3FeO + CO2 +1
І. Fe3O4 + CО = 3FeO + CO2 +1 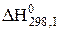 = 39,60 кДж;
= 39,60 кДж; = -18,13 кДж.
= -18,13 кДж. кДж.
кДж. <0, то при 298 К досліджувана реакція проходить з виділенням теплоти (екзотермічна реакція).
<0, то при 298 К досліджувана реакція проходить з виділенням теплоти (екзотермічна реакція). .
.
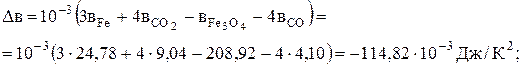


 .
.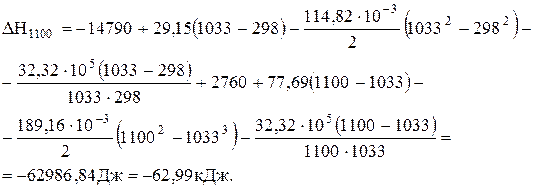
 з табл. Д.2.
з табл. Д.2.
 ;
;

 кДж.
кДж.