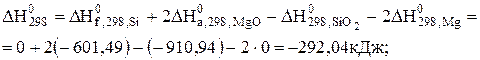|
|
Методи обчислення стандартної хімічної спорідненостіТемпература не входить в умови стандартної хімічної спорідненості. Звичайно визначають стандартну хімічну спорідненість при 298 К та при будь-якій інший температурі. Визначити стандартну хімічну спорідненість реакції при 298 К можна за допомогою стандартних ізобарних потенціалів утворення реагуючих речовин: стандартна хімічна спорідненість при 298 К дорівнює алгебраїчній сумі стандартних ізобарних потенціалів утворення кінцевих речовин (продуктів реакції) мінус алгебраїчна сума стандартних ізобарних потенціалів утворення вихідних (початкових) речовин, тобто
де ni – кількість моль і-ої речовини; Стандартним ізобарним потенціалом утворення сполуки ( Можна визначити якщо Х = ±mI ±nII ± … ±іІ,(5.9) то де Х – базова реакція, для якої визначають Докладніше метод розглянуто на стор. 26. В основі розрахунків стандартної хімічної спорідненості при будь-якій температурі лежить рівняння Гіббса-Гельмгольца (5.5)
яке можна розв'язати двома способами. Перший спосіб полягає в визначенні DНТ і DSТ за допомогою емпіричного ступеневого ряду теплоємкості (3.8;4.9). Тоді рів4няння Гіббса-Гельмгольца перетворюється в рівняння Тьомкіна-Шварцмана
де Мо, М1, М2 і М-2 – температурні функції, визначені Тьомкіним і Шварцманом. Температурні функції залежать тільки від температури. Їх величини для різних температур наводяться в довідниках (табл. Д.4). Якщо ж при визначенні DНТ і DSТ користуються функціями тепловмісту і приведеною енергією Гіббса (3.9;4.10), то рівняння Гіббса-Гельмгольца набуває вигляду
Задача 5.1.Процес виробництва міді в кольоровій металургії складається з декількох стадій. Спочатку сульфідну руду обпалюють до оксидів, потім проводять плавлення на штейн в присутності коксу і піску до Cu2S. Нарешті здійснюють конверторну плавку за реакцією 2Cu2O + Cu2S = 6Cu + SO2 і одержують чорнову мідь. Визначити стандартну хімічну спорідненість реакції при 298 і 1000 К. Зробити висновки про можливість самодовільної течії реакції за цих умов. Розв'язання.
Тоді
Таким чином, при 298 К
Задача 5.2.Визначити стандартну хімічну спорідненість при 298 і 1000К реакції X. SiO2 + 2Mg = Si + 2MgO, що застосовується у промисловому здобутті кремнію, а також вплив температури на хімічну спорідненість реакції. Розв'язання. Стандартну хімічну спорідненість реакції при 298 К визначимо шляхом алгебраїчного підсумовування допоміжних реакцій,
ІІ. MgO + C = Mg + CO -2 Зробивши перевірку за рівнянням (5.9), обчислюємо
Стандартну хімічну спорідненість при 1000 можна визначити за рівнянням (5.12)
Стандартний тепловий ефект реакції, а також зміну тепловмісту і приведеної енергії Гіббса обчислимо за рівняннями:
Отже
Таким чином, реакція відновлення кремнію і при 298, і при 1000 К самодовільно проходить у прямому напрямку. З ростом температури стандартна хімічна спорідненість реагуючих речовин зменшується.
ХІМІЧНА РІВНОВАГА
Хімічні реакції з будь-якого початкового стану не протікають, як правило, до повного перетворення початкових (вихідних) речовин в продукти. Вони йдуть лише до стану рівноваги. Звичайно при протіканні реакцій в металургійних процесах мають справу зі стійкою рівновагою. Це рівновага, при якій система, виведена із стану рівноваги будь-якою зовнішньою дією, повертається в стан рівноваги при припиненні цієї дії. Головними ознаками стійкої рівноваги є: - незмінність рівноважного стану при збереженні зовнішніх умов; - рухливість рівноваги – самодовільне відновлення рівноваги при припиненні зовнішньої дії; - динамічний характер рівноваги, тобто установлення і збереження рівноваги внаслідок рівності швидкостей прямої та зворотної реакцій; - можливість підходу до стану рівноваги з двох протилежних сторін; - мінімальне значення ізобарного потенціалу в момент рівноваги.
|
|
 , (5.8)
, (5.8) - стандартний ізобарний потенціал утворення речовини, Дж/моль.
- стандартний ізобарний потенціал утворення речовини, Дж/моль. і шляхом алгебраїчного підсумовування допоміжних реакцій,
і шляхом алгебраїчного підсумовування допоміжних реакцій,  , (5.10)
, (5.10) ; І, ІІ, … І – допоміжні реакції, стандартні хімічні спорідненості яких відомі -
; І, ІІ, … І – допоміжні реакції, стандартні хімічні спорідненості яких відомі -  ,
,  , …,
, …, 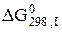 ; m, n, …, i – коефіцієнти при допоміжних реакціях.
; m, n, …, i – коефіцієнти при допоміжних реакціях.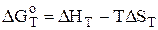 ,
, ,(5.11)
,(5.11) . (5.12)
. (5.12) визначимо за рівнянням (5.8), стандартні ізобарні потенціали утворення сполук візьмемо з табл. Д.2:
визначимо за рівнянням (5.8), стандартні ізобарні потенціали утворення сполук візьмемо з табл. Д.2:
 розрахуємо за рівнянням Тьомкіна-Шварцмана (5.11). Для цього спочатку визначимо:
розрахуємо за рівнянням Тьомкіна-Шварцмана (5.11). Для цього спочатку визначимо:


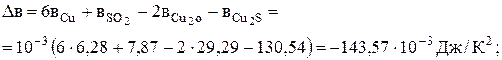
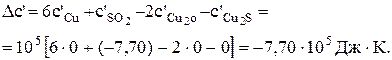

 що свідчить про можливість самодовільної течії реакції в прямому напрямку.
що свідчить про можливість самодовільної течії реакції в прямому напрямку. І. SiO2 + 2C = Si + 2CO +1
І. SiO2 + 2C = Si + 2CO +1  .
.