|
|
Физико-химические свойства и роль воды в биосфереВода так распространена на Земле, что обычно считается безвредной инертной жидкостью, удобной для разных практик. В биосфере же, она составляет ~ 65 % массы клеток. Т.о., лишь около 1/3 их массы приходится на т. н. «сухое вещество». Известно, что высокая электроотрицательность атома О и низкая – Н, делает химически стабильные молекулы воды диполями, способными к образованию Н-связей и, реже, к диссоциации на протон (Н+) и гидроксил (ОН-). Это так отличает свойства воды от молекул с близкой массой: Н2, СН4, NH3, СО2 и низших органических растворителей, что вызывает ряд дискурсов = логических цепей физико-химических и биологических следствий (рис. 2.1).
Рис. 2.1. Биологические следствия структуры и свойств воды Обратимая диссоциация молекул воды вызывает появление в ней ионов Н+ и ОН-, как и все ионы, покрытых многослойными ги-дратными оболочками. Хотя при 25 С, ионизируется лишь одна из 107 ее молекул, эта слабая склонность к ионизации делает настолько существенной роль Н+ и ОН- в физико-химических и биологических процессах, что ее выражают количественно: ионным произведением воды (Кw ), численно равным 1,0 .10-14. При равенстве концентраций Н+ и ОН-, в более чистой, чем дистиллят воде, раствор считают нейтральным, а его рН = 7. Этот показатель возник из выражения: рН = lg1/[H+] = -lg [H+], где –lg = р. Как видно из схемы (рис. 2.2) в кислом и щелочном диапазонах, сдвиги концентраций Н+ и ОН- всегда взаимозависимы = реципрокны, но, т.к. шкала рН логарифмическая, то ее сдвиг на 1 соответствует изменениям концентрации ионов в 10 раз!
В последнем случае, мэкв анионов и катионов всегда равны. В воде также растворимы электронейтральные оксосоединения диаметром 0,3-0,5 нм, включая низшие альдегиды, кетоны и спирты, вплоть до олигоз. Еще один класс растворимых в воде веществ – амфипатиче-ские = дифильные молекулы, имеющие наряду с полярными = ги-дрофильными и неполярные = гидрофобные группы. Их простейшая модель – мыла, то есть натриевые и калиевые соли высших (n = 12-22 С) жирных кислот, молекулы которых, на схемах обычно изображают «хвостатым» кружком, символизируя, соответственно,
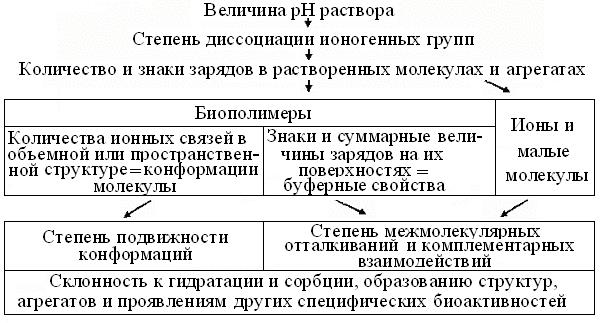
Рис. 2.3. Схема влияний рН раствора на свойства и поведение биомолекул и агрегатов Среди биомолекул нередки соли, а слабые кислоты и В, встречаются гораздо чаще сильных. Поэтому на рис. 2.3 дана схема дис-курса влияний величины рН растворов на структуру и активность ионогенных групп растворенных веществ. Очевидно, что эти воздействия так велики, что в лабораторной практике, за грубый критерий чистой воды принято ее сопротивление < 4 Ом. В биохимии и смежных практиках, измерения рН – одна из самых частых и важнейших процедурподготовки к анализам. Поскольку вода для клеток не только наполнитель и основной растворитель, но и реакционная среда, она находится в них в двух формах: свободной (до 95 %) и связанной с фибриллярными структурами цитоскелета и пр. (4-5 %). Большинство биохимических ре-акций в водных растворах происходит между полярными молекулами, причем свободная вода может быть, как их участником, так и продуктом. Но, т. к. основой гидратации и растворения всех молекул служит изменение Н-связей водных кластеров, оно сдвигает и 4 важнейших физических константы воды: температуры замерзания и кипения, давление пара над раствором и осмотическое давление. Так как знание концентраций растворов позволяет предсказать количественные сдвиги этих констант, их объединяют понятием кол-лигативные = взаимосвязанные свойства. Именно они и позволяют водным видам существовать при температурах ниже 0 С! До недавнего времени считалось, что из-за своих малых размеров, молекулы воды могут «проскальзывать» в клетки между сравнительно крупными молекулами мембранных фосфолипидов. Но, в 1988 г. Питер Эгр (Peter Agre) с коллегами выделил из мембран эритроцитов и проксимальных почечных канальцев, а позже подробно охарактеризовал мембранный белок-канал, названный аквапорин-1 (AQP1). Его тетрамер и образует полярную пору, способную проводить 3·109 молекул воды/с. Как теперь известно, аква-порины – обширное семейство белков всех без исключения плазматических мембран = ПМ и жестких клеточных оболочек = стенок прокариот, простейших, грибов и растений. Их физиологическая роль особенно заметна в таких функциях клеток, как поддержание осмотического давления, всасывание воды клетками корней растений и ее реабсорбция почкой животных, фильтрующих у человека ~150-200 л воды/сутки. Поэтому в первом приближении, у многоклеточных организмов различают 2 водных пространства = компартмента: внутри- и внеклеточное. Первое из них относительно постоянно, т.к. ограничено ПМ, удерживающей в клетке большинство ее компонентов. Напротив, количество внеклеточной воды сильно зависит от возраста, пола и числа сравнительно бедных ею, белых и бурых жировых клеток, соответственно липо- и адипоцитов. Поэтому рост количества жировых клеток снижает содержание воды у многоклеточных животных. В связи с репродуктивной ролью, в массе тела самок на 5-10 % больше жира, чем у самцов и, соответственно – меньше воды (табл. 2.1).
Таблица 2.1 Динамика содержания воды в массе тела людей (По М. М. Горн и др., 2000)
Из таблицы 2.2 видно, что перемещение растворенных в воде веществ основано на физико-химических принципах. Но их проявления сильно зависят, как от размеров и степени полярности самих биомолекул, так и от свойств гидрофобных биомембран и, таких надклеточных структур, как стенки капилляров и слои эпителиев, объединяемых понятиями гистогематических барьеров и барьерной функции.
Таблица 2.2 Основные механизмы перемещения молекул водных растворов в клетках и надклеточных системах
Очевидно, что избирательная = селективная проницаемость каналов транспорта молекул воды и порядка 50 типов ионных каналов, защищает все клетки от внешних воздействий, в то же время обеспечивая их связь с внешней средой и такие важные процессы, как создание мембранных потенциалов, секреция, мышечное сокращение и нейронная сигнализация. С нарушениями структуры и функций канальных белков связаны многие, в том числе, пока неизлечимые болезни. За фундаментальные открытия, связанные со структурой и функцией этих молекулярных машин, Нобелевская премия 2003 г. по химии присуждена Р. Мак-Киннону (Roderick MacKinnon) и П.Эгру (Peter Agre). По мнению экспертов, доказательства роли каналов сравнимы с достижением Уотсона и Крика, предложивших модель структуры ДНК. Кроме транспортных механизмов клетки (табл. 2.2) и характера распределения их белков в ПМ, на проницаемость тканей для воды и ионов неизбежно влияют форма и плотность расположения клеток, выраженность у них полюсов, базальных мембран и межклеточных контактов. Крайними примерами этих свойств могут служить одиночный, веретенообразный фибробласт и гематоэнце-фалический барьер, с максимально известной плотностью расположения эндотелиоцитов. Комбинации этих свойств в разных тканях, обеспечивающие надежность питания, межклеточной сигнализации и выведения из клеток конечных метаболитов, вынуждают различать у позвоночных 3 типа внеклеточных водных пространств: 1. Интерстициальная жидкость – водное окружение гликокаликса клеток, включая лимфу. У взрослых людей – 11-12 л. У новорожденных, относительно массы тела, ее примерно вдвое больше. 2. Внутрисосудистая жидкость – независимо от возраста ~7 % массы тела. От интерстициальной жидкости, пространство сосудов отграничено стенкой капилляров, образованной эндотелиоцитами и, секретированным ими же межклеточным веществом. 3. Трансцеллюлярные жидкости специализированных полостей тела: внутриглазная, спинномозгового канала, перикарда, плевры, синовиальная, пищеварительных соков и др. Их суммарный объем у человека – около 1 л. От интерстиция и внутрисосудистых пространств, их отделяют слои соответствующих эпителиев, обновляющих жидкости 6-8 раз в сутки с помощью механизмов секреции и реабсорбции. Для примера, в таблице 2.3 дано распределение важнейших ионов в водных компартментах позвоночных животных. Очевидно, что этот перечень можно продолжить ионами Ca2+, Mg2+, SO42- и низкомолекулярной органикой: глюкоза, лактат, цитрат, аминокислоты, мочевина и др., вплоть до белков, сконцентрированных в клетках и плазме крови.
Таблица 2.3 Распределение ионов (мэкв/л) в водных пространствах человека (По М. М. Горн и др., 2000, с изменениями).
Известно, что меру способности раствора создавать осмотическое давление, влияя тем самым на скорость движения воды, называют осмоляльностью. Ее выражают в миллиосмолях на кг воды (мОсм/кг), где 1 осмоль содержит 6 х 1023 частиц. Отсюда осмо-ляльность также определяют, как меру концентрации жидкостей или соотношение растворенных веществ и воды. Другой способ оценки концентраций растворов – осмолярность, т.е. количество частиц в 1 л раствора (мОсм/л). Но, так как водные биожидкости относительно разбавлены, то разница между осмоляльностью и осмолярностью невелика и, эти термины часто применяют, как взаимозаменяемые. 2.2. Дополнительная литература 2.2.1. Ленинджер А. Основы биохимии. – М.: Мир, 1974, 1976. – С. 44 – 61. Он же. Там же. 1985. Т. 1. С. 79 – 106. 2.2.2. Калинин Ф. Л. Основы молекулярной биологии. – Киев.: Вища школа, 1978. – С. 42-59. 2.2.3. Хочачка П., Сомеро. С. Биохимическая адаптация. – М.: Мир, 1988. – С. 206-390. 2.2.4. Досон Р. и др. Справочник биохимика. – М.: Мир, 1991. – 544 с. 2.2.5. Эккерт Р. и др. Физиология животных. – М.: Мир, 1991. – Т. 1. – Физические и химические концепции. – С. 19 – 48. 2.2.6. Горн М. М. и др. Водно-электролитный и кислотно-основной баланс. – М-СПб.: 2000. – 320 с. 2.2.7. Белянова Л. П. Лауреаты Нобелевской премии 2003 года по химии. «Природа» 2004. № 1. – С. 3-12. 2.2.8. Камышников В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике 2-е изд. перераб. и доп. МЕДПРЕСС-ИНФОРМ, 2004. – 920 с. 2.2.9. Будников Г. К., Медянцева Э. П. От электрода к электрорецептору // Химия и жизнь, 1991. – №7. – С 20 – 23. Экспериментальная часть 2.3.1. Приготовление ацетатных буферных растворов Договорившись между собой, каждая рабочая пара студентов готовит один из буферных растворов, приведенных в таблице 2.4.
Таблица 2.4 Соотношения объемов и величин рН ацетатных буферных смесей
С помощью мерных цилиндров и пипеток, по возможности точно отмеривают указанные объемы растворов 0,1 н. уксусной кислоты и ацетата натрия, смешивая их в конической колбе на 50 мл. Перемешав полученную смесь, получают буферный раствор с теоретически известной величиной рН. Затем, рН полученных смесей измеряют нижеуказанными способами, занося полученные результаты в каждый протокол опыта. 2.3.2. Измерения рН с помощью индикаторов Известно, что величины рН водных растворов можно оценить быстро, но приблизительно, с точностью до 0,5 единицы, с помощью растворов таких органических молекул, как лакмус, фенолфталеин, метилоранж и др. Этот способ основан на контрасте окрасок иона и молекулы индикатора, что, к сожалению, делает его неприменимым при работах с мутными и окрашенными жидкостями. Более практичны, особенно для работ в узких диапазонах рН – полоски фильтровальной бумаги, заранее пропитанные тем или иным раствором индикатора. Известно, что смеси растворов разных индикаторов, точки и зоны переходов которых перекрывают большую часть шкалы рН, называют универсальным индикатором. Для практических целей, особенно при работах в поле = вне лабораторий, такими смесями заранее пропитывают полоски бумаги, а на упаковке набора - обычно размещают шкалу рН. Исследуя рН раствора с помощью индикаторных полос, во избежание его загрязнения ЗАПРЕЩА-ЕТСЯ опускать их в раствор. Гораздо практичней, смочить в растворе чистую стеклянную или пластиковую палочку, носик или наконечник пипетки и, даже спичку или соломинку, после чего, влажным инструментом коснуться полоски. В таких случаях, раствор останется относительно чистым, а с помощью одной полоски - удастся провести несколько измерений.
2.3.3. Электрометрические измерения Они основаны на законе Нернста, рассмотренном в курсе аналитической химии. Поэтому ограничимся напоминанием, что, все подобные приборы, фактически включают 2 устройства: измерительную систему электродов и электронный усилитель потенциалов, входящий в аналитическую часть прибора. Именно на этом принципе основаны выпускаемые промышленностью рН-метры, кондуктометры и многочисленные модели электронных счетчиков частиц и клеток. В практике физиологических и клинических лабораторий, последние называют счетчиками форменных элементов крови или гематологическими анализаторами. Как правило, в такую систему входит насос, создающий ток жидкости через калиброванный капилляр, с впаянными в его стенки электродами. Любая частица, прошедшая между ними, повышает электрическое сопротивление цепи, что и отмечает электронный счетчик, обычно оснащенный дискриминатором, той или иной степени сложности. Надежность работы рН-метра, до начала занятия проверяет лаборант. Перед измерением рН раствора, один из студентов рабочей группы аккуратно приподнимает на штативе кронштейн с электродами, а другой рукой – убирает стакан с дистиллятом со столика магнитной мешалки. Осушив электроды фильтровальной бумагой, поставить на столик стакан с исследуемым раствором, а затем, избегая касаний электродной системой стенок стакана, аккуратно погрузить концы электродов в изучаемую жидкость. Измерения величины рН. На передней панели рН-метра последовательно нажать клавиши «анионы/катионы», «1 – 19» и «рХ». Через 1 мин, снять показания по нижней шкале рН-метра. Нажать клавишу диапазона, в пределах которого лежит найденная величина рН и, по верхней шкале прибора, еще раз снять его точные показания. Занести полученный результат в протокол опыта. По окончании измерений, последовательно отжать клавиши диапазона рН, «рХ» и «анионы/катионы». Приподнять кронштейн с электродами на штативе и другой рукой – убрать со столика магнитной мешалки стакан с раствором. Тщательно обмыть дистиллятом из промывалки поверхности электродов и, осушив их фильтровальной бумагой, аккуратно погрузить в стакан с дистиллятом. Слить из измерительного стакана в коническую колбу ацетатный буферный раствор с экспериментально установленным значением рН. Соблюдая оптимальный масштаб, построить график полученной зависимости значений рН (по оси абсцисс) от количества мл раствора ацетата натрия (по оси ординат). Сделать выводы. 2.3.4. Влияния разбавлений на рН буферного раствора С помощью пипетки отмерить 10 мл исходного ацетатного буфера и поместить их в мерную колбу на 50 мл. Довести объем раствора в колбе дистиллятом до метки. В соответствии с п. 2.3.3, измерить рН полученного раствора, занести результаты в протокол и сделать выводы.
2.3.5. Влияние кислот и щелочей на рН буферного раствора Пронумеровать 5 химических пробирок. В 3 первых из них, внести по 10 мл исходного буфера и еще в 2 – по 10 мл воды. Добавить в пробирки 1 и 4 по 1 мл 0,1 н раствора соляной кислоты = НCl. Соответственно, в пробирки 2 и 5 – внести по 1 мл 0,1 н. раствора гидроксида натрия = NaOH, а в пробирку 3 – 1 мл воды для контроля. Перемешать содержимое пробирок. С помощью универсального индикатора измерить рН полученных растворов и занести результаты в протокол. Сделать выводы. Вопросы для самоконтроля 2.4.1. Какие особенности структуры воды позволяют называть ее жидкостью с аномальными свойствами? 2.4.2. Какие свойства воды делают ее обязательным компонентом живых систем? 2.4.3. Чем объяснить высокое содержание воды в клетках и организмах? 2.4.4. Почему жизнедеятельность клеток зависит от количества воды в них? 2.4.5. Как определить количество воды в биоматериале? 2.4.6. Объясните понятие «сухое вещество». 2.4.7. Объясните понятие шкала рН. 2.4.8. Объясните понятие химический индикатор. Зачем их применяют? 2.4.9. Какие вещества пригодны на роль индикаторов рН? 2.4.10. Какие недостатки применения индикаторов вам известны? 2.4.11. На каком принципе основано применение рН метров? 2.4.12. Какие способы измерения рН вам известны? 2.4.13. Как выражают концентрации растворов неэлектролитов и электролитов? 2.4.14. Объясните понятие «мицеллы» и укажите их биологическую роль. 2.4.15. Объясните понятие «коллигативные свойства растворов» и укажите их роль в биологии. 2.4.16. Объясните влияние величины рН на растворимость и свойства биомолекул. 2.4.17. Объясните, почему 0,01 М., 0,1 М и 1 М фосфатные буферные растворы могут иметь одно и то же значение рН, например 7? 2.4.18. Объясните понятие «осмос» и укажите, от чего зависит осмотическое давление растворов? 2.4.19. Чем различаются осмолярность и осмоляльность водных растворов? 2.4.20. Какие водные пространства организмов животных вам известны и чем они разграничены? 2.4.21. Укажите основные механизмы движения биомолекул в клетках и организмах. 2.4.22. Как изменяется количество воды с возрастом? 2.4.23. Определите понятие «буферный раствор» и укажите их свойства. 2.4.24. Из каких компонентов состоят буферные системы и, в чем состоит суть их действия? 2.4.25. Какие буферные системы клеток и организмов Вам известны? 2.4.26. Как зависит количество воды от пола животных?
Задание на дом 2.5.1. В соответствии с предложенным шаблоном, опишите свойства растворов, как дисперсных систем
2.5.2. Чем объяснить высокую способность воды к растворению веществ? 2.5.3. Чем различаются понятия «гидратация», «набухание» и «растворение» веществ в воде? 2.5.4. Сгруппируйте типы веществ, способных растворяться в воде. В чем заключаются различия в их растворении? 2.5.5. Оцените средние размеры малых и полимерных биомолекул. 2.5.6. Чего больше в организме, внеклеточной или внутриклеточной воды? 2.5.7. От чего зависит содержание внеклеточной воды в организме? 2.5.8. Наибольшее количество воды содержит: а) цитозоль, б) эндоплазматическая сеть, в) рибосомы, г) митохондрии, д) ядро. 2.5.9. Известно, что спринтеры перед стартом интенсивно и глубоко дышат ~30 секунд, добиваясь гипервентиляции легких и удаления из них СО2. Почему при этом, рН крови может достигать 7,6? 2.5.11. В соответствии с предложенным шаблоном, заполните таблицу характеристики 4-х основных классов малых биогенных молекул = биомономеров. По какому принципу шла их селекция?
2.5.12. Оформляя протокол к занятию 3, соответственно шаблону, на развороте лабораторной тетради вычертить таблицу, для суммирования результатов качественных реакций:
|
|


 полярную головку и, термодинамически выгодную, растянутую конформацию углеводородной цепи. В водных растворах, их полярные головы ориентированы наружу для образования Н-связей с молекулами воды. Напротив, неполярные хвосты скрыты внутри сферических агрегатов = мицелл, где контактируют между собой с помощью гидрофобных взаимодействий. Такая структура позволяет мицеллам иметь переменный состав и относительно крупные размеры, придавая их коллоидным растворам мутность мыла, непрозрачность молока или млечных соков растений. Важно отметить, что мицеллы обычно играют транспортную роль в межклеточных пространствах и сосудах, тогда как основные коллоиды клеток – структурированные растворы молекул белков и РНК, как основных типов «молекулярных машин», имеют средний диаметр 4-10 нм.
полярную головку и, термодинамически выгодную, растянутую конформацию углеводородной цепи. В водных растворах, их полярные головы ориентированы наружу для образования Н-связей с молекулами воды. Напротив, неполярные хвосты скрыты внутри сферических агрегатов = мицелл, где контактируют между собой с помощью гидрофобных взаимодействий. Такая структура позволяет мицеллам иметь переменный состав и относительно крупные размеры, придавая их коллоидным растворам мутность мыла, непрозрачность молока или млечных соков растений. Важно отметить, что мицеллы обычно играют транспортную роль в межклеточных пространствах и сосудах, тогда как основные коллоиды клеток – структурированные растворы молекул белков и РНК, как основных типов «молекулярных машин», имеют средний диаметр 4-10 нм.