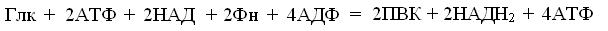|
|
ЗАНЯТИЕ 12. БРОЖЕНИЕ КАК МОДЕЛЬ ИЗУЧЕНИЯПРОЦЕССОВ МЕТАБОЛИЗМА 12.1. Вводные замечания. Процессы брожения применяют для получения хлеба, кисломолочных продуктов и других традиционных биотехнологий так давно, что переоценить их роль в развитии цивилизаций - невозможно. В середине XIX в., выполняя заказ виноделов, Луи Пастер нашел, что клетки дрожжей сбраживают сахар в этиловый спирт и СО2. Попутно он выявил и т.н. «эффект Пастера», то есть способность кислорода замедлять брожение. В 1897 г. Э. Бухнер доказал, что спиртовое брожение возможно и с помощью водного экстракта дрожжевых клеток. Затем обнаружили, что оно зависит от неорганического ортофосфата = Фн, исчезающего из среды по мере расхода глюкозы. Изолируя Е брожения, попутно идентифицировали гексозо- и триозофосфаты и, адениловые нуклеотиды. Комбинации этих приемов с добавками ингибиторов Е, с целью накопления межуточных метаболитов, позволили к середине ХХ в. выделить и установить последовательность всех 11 реакций дрожжевого брожения. В частности, Гарден и Ионг нашли, что тио-ловый Е D-глицеральдегид-З-фосфат: НАД+-оксидоредуктаза (фос-форилирующая, КФ.1.2.1.12) = ГАФ-дегидрогеназа, окисляя альдогруппу D-глицеральдегид-З-фосфата = ГАФ, вводит в него Фн. Но, так как стандартная свободная энергия гидролиза этого продукта: 1,3-дифосфоглицерата = ДФГ более отрицательна, чем у АТФ, то в следующей, ДФГ-киназной реакции возникают условия для субстратного фосфорилирования, обеспечивая клетку молекулой АТФ. Так, концентрация Фн в среде брожения стала мерой активности и длительности этого процесса. В итоге этих исследований возник ряд постулатов: 1. Брожение – процесс анаэробного окисления углеводов, к которому способен цитозоль любых клеток. 2. В основе брожения лежитгликолиз – линейная последовательность 10 реакций распада глюкозы до двух молекул пировиноградной кислоты = ПВК. Суммарно, их стехиометрию выражает уравнение:
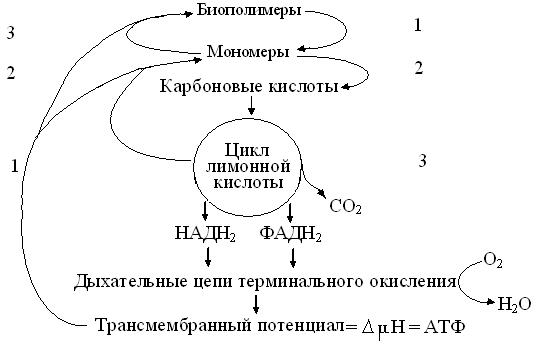
3. Вероятность и тип брожения зависят от наличия в организмах генов, экспрессирующих Е входа в гликолиз и выхода из него. Поэтому сбраживать крахмал, гликоген, сахарозу и т.д. могут не только проростки семян, но и большинство организмов, имеющих эндо- или экзоамилазы, гидролизующие полиозы и олигозы до глюкозы. Напротив, к сбраживанию целлюлозы способны лишь редкие виды почвенных прокариот и грибы, имеющие соответственно, структурносвязанные и водорастворимые целлюлазы. Поэтому грибы охотно живут на древесине, а поведение и способность животных питаться растениями, зависят от эффективности их морфофункционального симбиоза с бактериями ЖКТ. 4. Конечный продукт, определяя тип брожения, тоже зависит от экспрессии генов Е утилизации ПВК и регенерации НАДН2. Так, при молочнокислом брожении, свойственном большинству клеток, лактатдегидрогеназа = ЛДГ, регенерируя НАД для повтора ГАФ-дегидрогеназной реакции, обратимо восстанавливает ПВК в конечный продукт: лактат или молочную кислоту = МК. В отличие от них, клетки дрожжей имеют мощную декарбоксилазу ПВК. Поэтому при спиртовом брожениивыделяется СО2, а сброс водорода для регенерации НАД, уже на молекулу уксусного альдегида, восстанавливает ее до этанола. Аналогично, но при участии других Е заканчиваются и другие виды брожения, в том числе и пропионовокислое у жвачных. Подробней, эти вопросы обычно излагают в курсах микробиологии, зоотехники и пищевых биотехнологий. Таблица 12.1 суммирует подходы, с помощью которых энзимология и динамическая биохимия, ныне объединенные в метаболиту, за 100 лет изучили свыше 2500 управляемых ферментных реакций. Подобно процессам брожения и роли гликолиза в них, расшифровка этих пространственно-временных событий, с их последующей группировкой в десятки центральных и периферических цепей и циклов, позволили понять принципы и механизмы управления, с помощью которых метаболизм обеспечивает веществом, энергией и информацией, структуру и функции всех клеток и организмов. В частности, одним из важнейших достижений классической биохимии стало представление об обмене веществ, как трехэтапной открытой системе сопряжения реакций катаболизма – распада биополимеров пищи и тела, с процессами анаболизма, то есть синтезом специфических биополимеров, обеспечивающих клеткам стационарные состояния, сенсорику, адаптацию, рост, размножение и развитие. Глядя на схему (рис. 12.1) по часовой стрелке, видно, что цифры справа относятся к этапам катаболизма, а слева – к фазам анаболизма или биосинтезов. Понятно, что распад биополимеров до мономеров соответствующих классов (1) возможен как в клетках, так и внеклеточно.
Таблица 12.1 Иерархия препаратов и методов изучения метаболизма (По R.K. Murray et al., 1990 с изменениями)
К сожалению, энергия разрушаемых связей при этом не аккумулируется, автоматически делая его источником теплопродукции. Внеклеточные, чаще гидролитические реакции этого этапа отвечают за пищеварение, сигнализацию и защиту от инфекций. Напротив, множество его внутриклеточных реакций, имеющих разные механизмы, связано с процессингом РНК и фолдингом белков, управляющих гомеостазом, пролиферацией и апоптозом = гибелью клеток. Исторически, анаэробной фазой распадамоноз назвали их неполное окисление в цитозоле, в отличие от дыхания или аэробной фазы катаболизма углеводов, протекающей в митохондриях. Фактически же, в цитозоле до карбоновых кислот (2) анаэробно окисляется большинство мономеров (монозы, глицерол, аминокислоты), а в матриксе митохондрий (3) аэробно окисляютсявсе карбоновые кислоты, включая и высшие жирные.
Рис. 12.1. Трехэтапная схема метаболизма (пояснения в тексте)
Очевидно, что взаимопревращения карбоновых кислот в цитратном цикле (3) матрикса митохондрий, завершают распад органики реакциями декарбоксилирования, с выделением СО2 и поставкой водорода в дыхательные цепи внутренних мембран митохондрий = ВММ. Именно здесь, продольный транспорт электронов к О2, влечет перенос протонов поперек ВММ, приводя к образованию трансмембранного потенциала = ΔμН. Затем, АТФ-синтаза или комплекс V ВММ, сопрягает канальный транспорт пары протонов на ион кислорода, генерируя молекулу АТФ и, образуя этим способом свыше 90 % эндогенной воды. Лишь теперь, транслоказа митохондрий может обменять вновь образованную АТФ на равное количество АДФ цитозоля, возникшую в ходе энергопотребляющих процессов, обеспечив т.о., энергией, все этапы (1-3) анаболизма клетки. Изложенное позволило обобщить этап катаболизма (3) и анаболизма (1) в единый амфиболический процесс митохондрий, не только завершающий распад метаболитов, но и обеспечивающий начало их биосинтеза атомами углерода и энергией. Но, хотя по формальным признакам, стадии анаболизма 2 и 3, нередко сходны с реакциями стадий 1 и 2 катаболизма, они принципиально различны по источникам энергии и водорода, локализации ключевых Е в органоидах и способам автоматического контроля процессов. Это особенно заметно при сравнении простых реакций гидролиза биополимеров, со сложными, но надежными механизмами матричных биосинтезов нуклеиновых кислот и белков. Вышеописанные достижения превратили классическую биохимию в нынешнюю молекулярно-клеточную биологию, способную к принципиально новым поточным технологиям массовой диагностики, сравнения геномов и протеомов, создания генномодифицированных организмов = ГМО, ликвидации ранее неизлечимых болезней и голода на планете. Одновременно они подтвердили эволюционное единство биоразнообразия и, с большой долей вероятности позволили судить о причинах и механизмах эволюциибиосферы. Согласно современным взглядам, все нынешние клетки унаследовали гликолиз от пробионтов, зародившихся в водной среде, при тогда восстановительной атмосфере Земли и, гетеротрофно питавшихся органикой абиогенного происхождения. Размножение клеток и истощение пищевых ресурсов вызвали жесткую конкуренцию, резко меняя характер и ускоряя ход эволюции. Видимо, исключительным событием было появление бактериального фотосинтеза у пробионтов, способных к азотофиксации. Освободив хозяев от пищевой зависимости, фотосинтез сделал их автотрофами, но накопление в атмосфере кислорода, как побочного продукта, блокировало абиогенный синтез органики. Кислород так усложнил жизнь первичных анаэробных хемотрофов, что большинство их вымерло, а до наших дней дожили лишь те археи, что нашли бескислородные среды в экстремальных условиях вулканов, горячих, кислых и глубинных вод, рассолов и болот. Зато, возникший в атмосфере озоновый экран, принципиально меняя ход эволюции, защитил уцелевших пробионтов от смертельно опасного УФО. Скорей всего, что, освоив окислительное фосфорилирование, часть пробионтов стала первичными аэробными эубактериями или вторичными гетеротрофами. Другие же пробионты, поглотив, но, не переварив их, вступили с вторичными гетеротрофами в симбиоз, сохранив как энергостанции, этих предков митохондрий нынешних эукариот. Видимо, так появились вторичные аэробы, развившиеся в царства животных и грибов. Наконец, третья часть пробионтов, «заключив союз», как с аэробными гетеротрофами, так и с первичными фотосинтетиками, сохранила последние как митохондрии и хлоропласты, от которых и пошло царство растений.
12.2. Дополнительная литература 12.2.1. Скулачев В. П. Энергетика биологических мембран. – М.: Наука, 1989. – 564 с. 12.2.2. Кулаев И. С. Неорганические полифосфаты и их роль на разных этапах клеточной эволюции. //Соросовский образовательный журнал, 1996. – № 2. – С. 28 – 35. 12.2.3. Кулинский В. И. Активные формы кислорода и оксидативная модификация макромолекул: польза, вред и защита. //Соросовский образовательный журнал, 1999. – №1. – С. 2 – 7. 12.2.4. Ньюсхолм Э., Старт К. Регуляция метаболизма. – М.: Мир, 1977. – 405 с. 12.2.5. Хочачка П., Сомеро Дж. Биохимическая адаптация. – М.: Мир, 1988. – 566 с. 12.2.6. Готтшалк Г. Метаболизм бактерий. – М.: Мир, 1982. – 310 с. 12.2.7. Брухман Э. Э. Прикладная биохимия. – М.: Легкая и пищевая промышленность, 1981. – 296 с. 12.2.8. de Cruif P. Охотники за микробами. – Молодая гвардия, 1957. – 488 с.
Экспериментальная часть Как уже сказано, спиртовое брожение – простая и удобная модель для освоения основных приемов изучения метаболизма. Мерой его активности служит динамика изменений концентрации Фн в среде брожения за определенные отрезки времени.
12.3.1. Подготовка, инкубация и контроль системы брожения 1. Студенты-добровольцы или дежурные, по указанию лаборанта занимают рабочее место с необходимой посудой, растворами и готовыми навесками дрожжей и глюкозы по 1,5 г. 2. Один из студентов маркирует 4 центрифужных пробирки и, разлив в них по 1 мл 10 % раствора трихлоруксусной кислоты = ТXУ, помещает пробирки в ледяную баню. 3. Параллельно, другой студент смешивает в фарфоровой ступке навески дрожжей и глюкозы и, по возможности, растирает их пестиком, постепенно добавляя к смеси 20 мл дистиллята, порциями по 2-5 мл. 4. Количественно перенести смесь в коническую колбу на 100 мл, омыв ступку и пестик 10 мл 0,01 М фосфатного буфера рН 7,4. 5. Перемешав содержимое колбы, тут же отобрать из нее для контроля 1 мл взвеси и, для осаждения белков, перенести его в стоящую во льду пробирку № 1. 6. Поместить колбу с системой брожения в термостат при 37 С и установить таймер на 15 мин. 7. Каждые 15 мин по звонку таймера, дежурные отбирают из колбы пробы по 1мл, соответственно помещая их в стоящие на льду пробирки № 2, 3 и 4. 8. Соответственно пробиркам, пронумеровать 4 мерных колбы на 25 мл для последующих разведений центрифугата. 9. По окончании инкубации, с термостатом, системой брожения и оборудованием рабочего места поступить по указанию лаборанта. 10. Через 10 мин после осаждения белков в пробе 4, пробирки извлечь из ледяной бани и, в соответствии с работой 6.3.1, попарно уравновесить их на центрифужных весах, после чего разместить по диаметру ротора центрифуги. 11. Убедившись, что все студенты выполнили п. 10, закрыть центрифугу крышкой и, соблюдая правила работы с нею (п. 1.1.20), включить центрифугу при 2000 об/мин на 10 мин. 12. Учитывая высокую чувствительность фосфомолибдатного метода анализа и пределы его калибровочного графика (см. п. 12.3.2.), развести надосадки в 50 раз. Для этого: 13. Меняя наконечники полуавтоматического дозатора на 500 мкл, перенести по 0,5 мл каждого надосадка в соответственно пронумерованные мерные колбы. 14. Довести водой до меток объемы их содержимого.
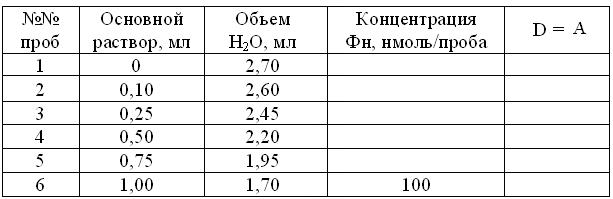
12.3.2. Количественноеопределение ортофосфата методом Лоури-Лопеца Принцип метода: Основан на образовании фосфомолибдатного комплекса (Н7[Р(Мо2О7)6] х nН2О), который восстанавливают гидрохиноном и др. до молибденовой сини, колориметрируя затем интенсивность окраски. Белки, мешающие определению Фн, предварительно удаляют из проб общепринятыми способами. Один из самых простых и чувствительных (35-50 нмоль Фн на пробу) – метод Лоури-Лопеца, где восстановитель – аскорбиновая кислота. Ход работы: 1. За время инкубации системы брожения, каждая рабочая пара студентов маркирует 10 пробирок: 6 – для построения калибровочных проб и еще 4 – для разведенных центрифугатов. 2. В соответствии с таблицей 12.2, в пробирки 1-6 внести указанные объемы основного 10-4 М раствора Na2HPO4 х 2H2O и дистиллята. Таблица 12.2 Калибровка растворов для определения неорганического фосфата = Фн
3. Получив у дежурных мерные колбы 1 – 4 с разведенными центрифугатами исследуемых проб, отобрать из каждой по 2,7 мл раствора и, соответственно перенести их в пробирки 7 – 10. 4. Получить у лаборанта свежеприготовленные 1 % растворы: а) молибдата аммония (NH4)Mo7O24 х 4Н2О в 6 н серной кислоте; б) аскорбиновой кислоты в 0,0005 н растворе сульфата меди (CuSO4 х 5H2O). 5. Во все 10 рабочих пробирок добавить по 0,4 мл 1 % раствора молибдата аммония. 6. Точно через 5 мин, также во все пробирки добавить по 0,4 мл 1% раствора аскорбата и, тщательно перемешав пробы, оставить их точно на 20 мин на столе для развития окраски. 7. В соответствии с работой 4.3.1, прогреть ФЭК КФК-2. 8. Фотометрировать все 10 проб против воды, в кюветах на 5 мм и красном светофильтре, занося соответственно, результаты калибровки в таблицу 12.2, а исследуемых проб – в таблицу 12.3 протокола занятия. 9. По аналогии с работой 7.3, на основании данных таблицы 12.3 построить калибровочный график зависимости А = абсорбции раствора от концентрации Фн в пробах. 10. С помощью калибровочного графика и, с учетом разведения проб в 50 раз, рассчитать и внести в таблицу 12.3. концентрации Фн в инкубационной среде. Таблица 12.3 Динамика убыли ортофосфата в инкубационной среде в процессе брожения
11. По результатам опыта, построить график динамики убыли фосфата в процессе брожения и сделать выводы.
Вопросы для самоконтроля 12.4.1. Дайте современную формулировку понятия «брожение». 12.4.2. Какой процесс лежит в основе всех типов брожения? 12.4.3. Как объяснить блокирование процессов брожения при отсутствии неорганического фосфата в инкубационной среде? 12.4.4. Чем объяснить токсичность арсенатов для биоты? 12.4.5. Как блокирует гликолиз моноидуксусная кислота? 12.4.6. Чем различаются разные типы брожения? Приведите примеры их применения. 12.4.7. Как объяснить торможение процессов брожения в присутствии кислорода? 12.4.8. Чем объяснить образование CO2 и накопление этанола при спиртовом брожении? 12.4.9. На каком принципе основаны колориметрические методы определения неорганического фосфата? 12.4.10. Как выявить в воде и биожидкостях органические соединения фосфата? 12.4.11. Стандартное количество энергии (G0), необходимое для синтеза 1М АТФ из АДФ и Фн составляет 30 кДж. Вычислите количество свободной энергии, необходимое для синтеза АТФ в клетке печени, при их физиологических концентрациях, соответственно равных 3,5; 1,5 и 5,0 мМ. 12.4.12. Известно, что суточная норма питания здорового человека массой 70 кг составляет ~2000 ккал. Приняв эффективность окислительного фосфорилирования за 40%, рассчитайте соответствующее количество синтезируемых молекул АТФ. 12.4.13. Концентрация АТФ в мышцах составляет ~8 мМ. При интенсивной мышечной работе, она расходуется со скоростью 30 мкмоль/мин на 1 г мышечной ткани: а) на какое время хватит этого запаса АТФ спринтеру; б) на сколько позволит растянуть бег креатинфосфат, если его концентрация в мышцах составляет около 40 мкМ; в) почему возможен марафонский бег? 12.4.14. Чем объяснить, что в митохондриях бурого жира отношение Р/О составляет около 1? Какова его функция? Когда и у какого таксона, его легче обнаружить?
Задание на дом 12.5.1. При оформлении протокола и подготовке к занятию 13, определите понятие «углеводы». Вспомните принципы их строения, свойства, классификацию и биологическую роль. 12.5.2. Попытайтесь построить таблицу, отразив в ней известные вам отрасли, объекты и цели, с которыми в них выявляют глюкозу. 12.5.3. Вспомните, что Вам известно о механизмах фотосинтеза в бактериях и хлоропластах клеток эукариот? 12.5.4. Что Вы знаете об основных углеводах пищи животных, их суточной потребности и эволюции их переваривания? 12.5.5. Как происходит транспорт глюкозы и других моноз в клетки? Что Вы знаете о строении и тканеспецифичности их транспортеров? 12.5.6. В чем заключается внутриклеточная «активация» глюкозы? 12.5.7. Попытайтесь самостоятельно создать обзорную схему источников и путей расхода глюкозы в клетках. 12.5.8. Что Вы знаете о структуре и функциях свободных и связанных олигоз? 12.5.9. Попытайтесь сравнить структуру, свойства и функции ацетилнейраминовой, ацетилмурамовой и тейхоевой кислот. 12.5.10. Исходя из механизма биосинтеза резервного полисахарида животных гликогена, попытайтесь сформулировать принцип полимеризации глюкозы в других олиго- и полиозах. 12.5.11. Что Вы знаете о тканеспецифичных механизмах управления биосинтезом и мобилизацией гликогена? 12.5.12. Что Вам известно об окислительной и изомеразной половинах пентозофосфатного цикла окисления глюкозы? Какую роль он играет в процессе фотосинтеза и анаболизме тканей животных? 12.5.13. Сформулируйте понятие «гликолиз» и охарактеризуйте его этапы. 12.5.14. Что такое «субстратное фосфорилирование» и в чем заключается его роль в жизнедеятельности? 12.5.15. Как достигается автоматизм поддержания реакций гликолиза? 12.5.16. Охарактеризуйте последовательность стадий аэробного окисления глюкозы и сравните его энергетический эффект с эффективностью гликолиза. 12.5.17. Сформулируйте понятие «глюконеогенез» и расскажите о роли компартментов клетки, ключевых Е, макроэргических соединениях и биотина, участвующих в этом процессе. 12.5.18. Попытайтесь создать схему включения в процесс глюконеогенеза молочной кислоты, глицерола, метаболитов цикла лимонной кислоты и аминокислот. 12.5.19. Что Вы знаете об аллостерических и генетических механизмах управления процессами гликолиза и гликонеогенеза в клетках? 12.5.20. Объясните смысл цикла Кори = взаимосвязи гликолиза в работающей мышце, с гликонеогенезом в печени. 12.5.21. Чем объяснить, что в отличие от перелётных птиц, куропатки, фазаны, перепела и т.д., устают в полёте очень быстро?
|
|