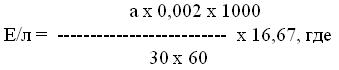|
|
ЗАНЯТИЕ 11. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ ИСВОЙСТВА ФЕРМЕНТОВ
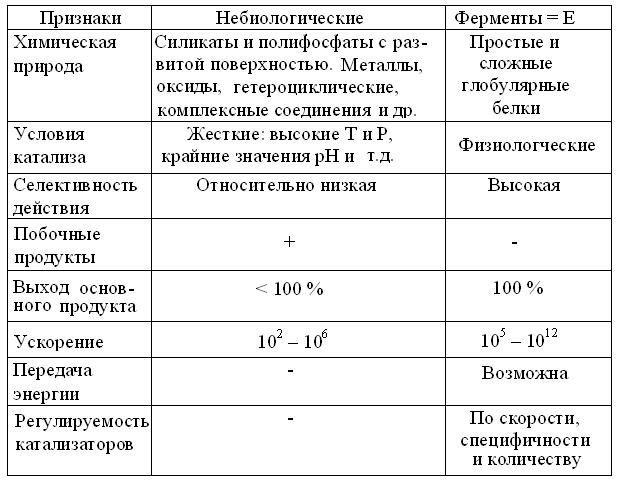
11.1. Общие замечания. Из курсов химии известно, что катализ – процессвозбуждения и ускорения химических реакций, а термин ингибитор (лат. inhibire – угнетать) – несет обратный смысл. Функция катализаторов состоит в реакциях с исходными веществами = субстратами, с образованием промежуточных соединений в новых переходных состояниях, способных: образовать продукты при сниженной энергии активации и регенерировать катализатор. Поэтому катализатор участвует в реакции многократно и в стехиометрии реакций = количественном соотношении их компонентов, его нужно гораздо меньше, чем субстратов. Механизмы химического и биологического катализа принципиально одинаковы, но в физиологических условиях водных растворов, ферменты гораздо эффективней (табл. 11.1), т.к. намного больше снижают свободную энергию переходного состояния и имеют ряд других преимуществ.
Таблица 11.1 Сравнение свойств катализаторов (по А. Lehninger, 1974, с изменениями)
Причины высокой эффективности биокатализа суммирует схема (рис. 11.1). Очевидно, что относительное пространственное соответствие функциональных групп, позволяет без затрат энергии связать субстрат(ы), сразу в нескольких точках активного центра Е. Образование фермент-субстратного комплекса вызывает ряд множественных эффектов. Так, межмолекулярные отношения сменяются внутримолекулярными, а гетерогенный катализ – гомогенным, изолируя субстрат от водной среды. Параллельно индуцируется полная комплементарность между функциональными группами Е и субстрата (D. Koschland), что в свою очередь, деформирует в последнем ковалентные связи и оптимизирует возможности полифункционального катализа.
Рис. 11.1. Схема множественности эффектов биокатализа
Из-за отсутствия специфических индикаторов, о наличии и каталитической активности Е судят во времени, по скорости убывания субстрата или нарастания количества продукта. В системе СИ основной каталитической единицей принят катал (символ – кат.), т.е. способность ускорять реакцию на 1 моль/с, в заданной системе измерения активности. Так как для практических целей эта единица слишком велика, обычно используют ее степенные производные: микрокатал (мк-кат = 1 мкмоль/с), нанокатал (нкат = 1 нмоль/с) и пикокатал (пкат = 1 пмоль/с). К производным величинам относят: удельную и молярную каталитическую активности, соответственно, кат/кг ферментного препарата и кат/моль Е. Хотя комиссия по номенклатуре Международного биохимического союза не рекомендует применять международные единицы активности Е, связанные с именами разработчиков систем их тестирования, например единицы Вольгемута для амилазы и т.п., они еще встречаются в литературе. Для пересчета их в систему СИ и обратно, полезны эмпирические формулы:
Благодаря высокой избирательности и активности, Е, в частности микроорганизмов, издавна широко применялись в таких традиционных биотехнологиях, как хлебопечение, сыро- и виноделие, выделка кож и тканей, компостирование и т.д. Появление методов количественного анализа Е, а потом индивидуальных и сопряженных индикаторных ферментных реакций (табл. 4.3), обеспечило точный количественный экспресс-анализ метаболитов для лабораторной и промышленной диагностики. Наконец, совершенствование методов иммобилизации Е в мицеллах, гелях т.д., привело к новым биотехнологиям, связанным с их применением в колонках, проточных реакторах и пленочных = мембранных электродах.
11.2. Дополнительная литература 11.2.1. Номенклатура ферментов. – М.: ВИНИТИ, 1979. – 320 с. 11.2.2. Кочетов Г.А. Практическое руководство по энзимологии. – М.: Высшая школа, 1980. – 272 с. 11.2.3. Скоупс Р. Методы очистки белков. – М.: Мир, 1985. – 358 с. 11.2.4. Варфоломеев С. Д., Гуревич К. Г. Биокинетика. – М.: ФАИР-ПРЕС, 1999. – 720 с. 11.2.5. Плакунов В.К. Основы энзимологии. – М.: Логос, 2001. – 128 с. 11.2.6. Бейли Дж., Оллис Д. Основы биохимической инженерии. – М.: Мир, 1989. В 2-х томах. 11.2.7. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. – М.: Мир, 2002. – 589 с.
Экспериментальная часть Амилаза слюны (КФ 3.2.1.1) – простая и доступная модель, для освоения основных приемов работы с Е. Соответственно схеме (рис. 11.2), в физиологических условиях она ведет ступенчатый эндогидролиз α-1,4-гликозидных связей в полиозах. Об этом можно судить по убыли реакции с йодом или нарастанию восстанавливающей способности сахаров, содержащих свободный полуацетальный гидроксил, например, с помощью качественных реакций Троммера, Бенедикта и др.
Рис. 11.2. Схема ступенчатого гидролиза полиоз под действием эндоамилаз слюны и поджелудочной железы
11.3.1. Получение разведенного препарата амилазы слюны 1. Студент-доброволец или дежурный, ополоснув рот водой 2-3 раза, собирает в пробирку с воронкой до 4 мл слюны. 2. Под контролем лаборанта, отобрать точно 3 мл слюны из пробирки и перенести в мерный цилиндр на 50 мл. 3. Избегая вспенивания, осторожно добавить в цилиндр воды до метки 30 мл и перемешать раствор стеклянной палочкой. 4. Слить, а при необходимости фильтровать раствор в стакан, отметив разведение слюны в 10 раз. 5. 10 мл разбавленной в 10 раз слюны поместить в тот же цилиндр, довести его водой до верхней метки, пометив, как разведение в 50 раз. 6. Оба препарата амилазы предоставить для работы подгруппе студентов. Внимание! Во всех работах использовать препарат амилазы, с разведением в 10 раз и, лишь в работе 11.3.5, для выявления зависимости активности Е от рН, применить разведение в 50 раз.
11.3.2. Количественное определение активности амилазы слюны способом Вольгемута Принцип метода: Основан на последовательном разведении препарата амилазы водой с помощью «переката», после чего во все пробирки добавляют равные количества субстрата: раствора крахмала и инкубируют их при постоянной температуре. Окончив инкубацию, останавливают процесс гидролиза и, с помощью раствора йода, как индикатора на крахмал, выявляют наличие субстрата в пробирках. Зависимость между этими величинами (Жеребцов и др., 2002) сведена в таблицу:
Ход работы: 1. В соответствии с протоколом опыта, оформленным в виде таблицы:
в 10 пронумерованных пробирок разлить точно по 1 мл воды. 2. Добавить в первую пробирку 1 мл слюны с разведением в 10 раз и, избегая вспенивания, хорошо перемешать раствор с помощью пипетки. 3. Той же пипеткой перенести 1 мл содержимого из первой пробирки во вторую, из второй – в третью и т.д., каждый раз, тщательно перемешивая их содержимое. Закончив «перекат», удалить из последней (десятой) пробирки 1 мл смеси. 4. Во все пробирки с полученной серией разведений слюны добавить точно по 2 мл 0,1 % раствора крахмала, тщательно перемешивая их содержимое. 5. Пометить свой штатив и поместить его в водяную баню с качалкой при 40 С (313 К), оставив для инкубации точно на 30 мин. 6. По истечении времени инкубации, вынуть свой штатив с пробирками из бани и, тут же охладить его водой из под крана, в течение 1-2 мин. 7. В каждую пробирку добавить по 1-2 капли раствора Люголя (1 % раствор йода в 2 % растворе иодида калия), в качестве индикатора на крахмал. 8. Содержимое пробирок перемешать и, наблюдая развитие окраски, занести результаты в таблицу протокола опыта. 9. Рассчитать активность амилазы (Е/л) в пробах по следующей формуле:
а – разведение слюны в последней пробирке с желтой окраской; 0,002 – количество грамм крахмала в пробе; 1000 – коэффициент пересчета миллилитров в 1 л; 30 – время инкубации в минутах; 60 – коэффициент пересчета минут в секунды.
10. Занести результаты расчетов в таблицу протокола. В норме, активность амилазы в слюне человека 3-7 нкат/л. Однако, существенной диагностической ценности она не имеет.
11.3.3. Выявление специфичности амилазы 1. В 2 маркированных пробирки поместить по 5 капель слюны, разведенной в 10 раз. 2. В одну из них добавить 10 капель 0,2 % раствора крахмала, а в другую – столько же 0,2 % раствора сахарозы. 3. Пометив свою пару пробирок, поместить ее на 10 мин для инкубации, в штатив водяной бани с качалкой, при 40 С (313 К) или подогреть на пламени. 4. Вынув пробирки из бани, для выявления в них сахаров с восстанавливающими свойствами, проделать с содержимым качественную реакцию Троммера. Для этого, соблюдая осторожность: 5. В обе пробирки добавить по 10 капель 10 % раствора едкого натра (NaОН), а затем – по 10 капель 1 % раствора сульфата меди (CuSO4). 6. Соблюдая правила нагрева посуды в пламени (п. 1.1.18), прокипятить содержимое обеих пробирок на тигле с сухим горючим, зарегистрировать результаты и, занести их в протокол опыта для последующего истолкования.
11.3.4. Зависимость активности амилазы от температуры 1. В 4 маркированных пробирки разлить по 2 мл 0,2 % раствора крахмала. 2. Разместить пробирки: № 1 – в чашке со льдом; № 2 – в штативе на лабораторном столе; № 3 – в водяной бане с качалкой при 40С и, № 4 – в кипящей водяной бане. 3. Для контроля хода гидролиза субстрата с помощью йодной реакции, поместить во все пробирки стеклянные палочки. 4. Через 5-7 мин, когда растворы субстрата примут окружающую температуру, во все пробирки добавить по 0,5 мл слюны, разведенной в 10 раз. 5. Для лучшего контакта Е с субстратом, перемешать содержимое пробирок. 6. Через 2 мин нанести на предметное стекло 4 отдельных капли раствора Люголя и, с помощью стеклянных палочек, смешать с ними по капле инкубационных смесей из пробирок. 7. Высушив палочку фильтровальной бумагой, вернуть ее в соответствующую пробирку и занести результаты йодного теста в протокол опыта, оформленный в виде таблицы:
8. Повторять пп. 6 и 7 каждые 2 мин, пока реакция с йодом на крахмал, не станет отрицательной. 9. Немедленно собрать все 4 пробирки в штатив и охладить их водопроводной водой. 10. Добавить по 1-2 капли раствора Люголя во все пробирки и перемешать содержимое. 11. Занести результаты йодной реакции в соответствующие графы таблицы и обдумать полученные результаты. 11.3.4. Зависимость активности амилазы от величины рН инкубационной смеси. 1. В соответствии с таблицей протокола опыта,
в 5 маркированных пробирок слить указанные объемы растворов фосфата натрия для получения буферных растворов с заданными величинами рН. 2. В каждую из пробирок добавить по 1 мл 0,2 % раствора крахмала и по 1 мл слюны, разбавленной в 50 раз. 3. Перемешав содержимое пробирок, поместить их в водяную баню с качалкой или термостат при 40 С (313 К) на 7-10 мин. 4. Вынув пробирки из бани = термостата, быстро охладить их водопроводной водой. 5. Добавить по 1-2 капле раствора Люголя и, тщательно перемешать содержимое. 6. Результаты опыта занести в таблицу протокола и, пользуясь схемой рисунка 2.3, сделать выводы.
Вопросы для самоконтроля 11.4.1. В чем, по вашему мнению, заключается функция катализаторов? 11.4.2. Сформулируйте представления о преимуществах биокатализа, по сравнению с небиологическими катализаторами. 11.4.3. Объясните природу и химический состав Е. 11.4.4. Объясните причины и механизмы высокой эффективности биокатализа. 11.4.5. По каким признакам можно судить о наличии того или иного Е? Каким термином выражают это понятие? 11.4.6. В каких основных и производных единицах выражают активность Е? 11.4.7. Какую химическую реакцию катализируют амилазы? 11.4.8. На примере амилазы слюны, сформулируйте принципиальные положения количественного анализа Е. 11.4.9. Что Вы знаете о кинетике и общих свойствах Е? 11.4.10. Что вы помните о классификации и номенклатуре Е и кофакторов ферментативных реакций? 11.4.11. Что значит понятие «термолабильность»? Объясните причины и характер зависимости ферментных реакций от температуры. 11.4.12. Объясните причины и характер зависимости ферментных реакций от величины рН. 11.4.13. Применительно к энзимологии, объясните термин «ингибиторы» и приведите примеры их применения. 11.4.14. Где, по вашему мнению, применимы знания и понятия энзимологии? 11.4.15. Сформулируйте представления об индикаторных ферментных реакциях. 11.4.16. Что такое ферментный анализ, где и для чего он применим? Задание на дом 11.5.1. При оформлении протокола и подготовке к занятию 12, расскажите об уровнях и методах изучения метаболизма. 11.5.2. Что Вы знаете о роли неорганических и органических соединений фосфатов в процессах жизнедеятельности? 11.5.3. Что Вам известно об организации общих и специфических путей метаболизма и принципах управления ими? 11.5.4. Попытайтесь определить термин «брожение». 11.5.5. Что Вы знаете о структуре, свойствах и функциях митохондрий и их компартментов? 11.5.5. Расскажите об амфиболической роли цикла лимонной кислоты, реакциях его пополнения и принципах контроля. 11.5.6. Расскажите об организации и биологической роли дыхательных цепей в митохондриях и других органоидах. 11.5.7. Как и за счет чего, возникает трансмембранный электрохимический потенциал протонов на внутренней мембране митохондрий? 11.5.8. Расскажите о механизме окисления водорода субстратов в эндогенную воду и роли адениловых нуклеотидов в окислительном фосфорилировании и дыхательном контроле. 11.5.9. Что Вы знаете о способах использования энергии, аккумулированной в клетках? 11.5.10. Особенности строения митохондрий и функция адипоцитов бурой жировой ткани. 11.5.11. Расскажите о понятии «гипоэнергетические состояния» и их возможных причинах. 11.5.12. Что Вы знаете о причинах и механизмах образования активных форм кислорода = АФК? 11.5.13. Что Вам известно о мишенях и способах защиты от АФК? 11.5.14. Что Вы знаете о механизмах неспецифической защиты от инфекций?
|
|