|
|
ЗАНЯТИЕ 3. ТИПЫ, ДОЗИРОВКА И СПОСОБЫАНАЛИЗА РАСТВОРОВ
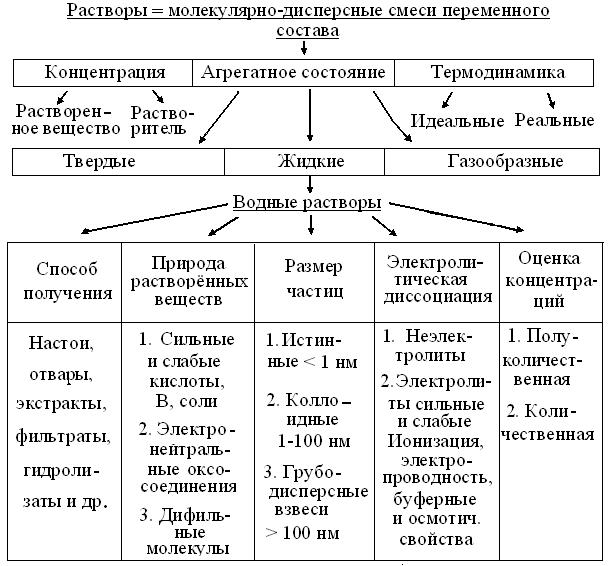
3.1. Растворы: типы и области применения. Известно, что системы с концентрационным преобладанием одного из компонентов называют растворами. Исходя из конкретных свойств, важных в данное время, их рассматривают с разных позиций (рис. 3.1). Если термин употребляют без уточнений, обычно имеют в виду жидкие растворы. Но, т.к. из всех жидкостей, на Земле и в биосфере преобладает вода, то чаще всего в быту, технике и биологии встречаются водные растворы веществ, уже рассмотренных в Занятии 2.
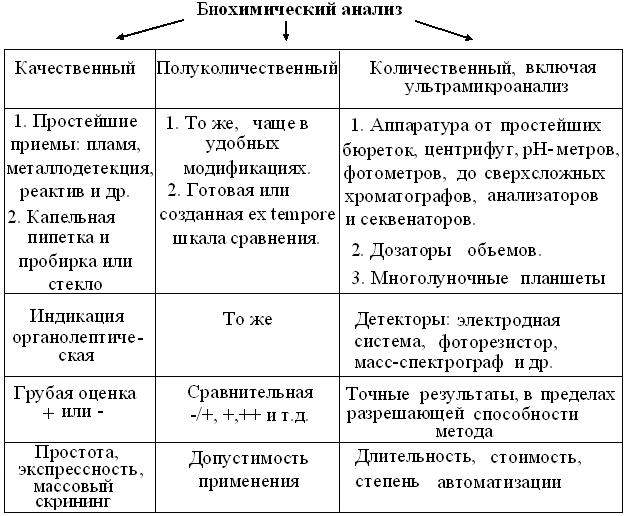
Рис. 3.1. Схема подходов к растворам Очевидно, что в зависимости от конкретных задач, есть 2 принципиально разных способа получения растворов: из природного, чаще растительного сырья и, навесок чистых препаратов. Как известно, большинство водных растворов готовят с помощью обычной мерной посуды, ускоряя при необходимости их растворение нагревом систем в конических колбах. Но, при растворении биополимеров нужно учитывать возможность их частичной или полной денатурации, в том числе, и от контакта полимера со стеклом или интенсивного перемешивания. Кроме того, лиофилизированные препараты биополимеров очень летучи, создавая неудобства при взвешивании и редко растворяются в дистилляте. Наконец, как известно, растворению полимеров всегда предшествует стадия набухания их молекул. Поэтому их растворы готовят накануне применения, с помощью рекомендованных и охлажденных буферных смесей и пластиковой посуды, избегая интенсивного перемешивания и образования пены, после чего - хранят в холодильнике. Из схемы 3.1 также видно, что независимо от способа получения, природа растворенных веществ прямо определяет размер частиц и степень гомогенности раствора, его оптические и кинетические свойства. При этом, степень склонности веществ к электролитической диссоциации, соответственно сохраняет или повышает количество частиц в растворе. В последнем случае, ионы разных знаков обеспечивают раствору новое свойство электропроводности. Наконец, часть, не менее чем трехкомпонентных систем электролитов, способных поддерживать постоянство рН при добавлении сильных кислот или оснований, называют буферными растворами. При полуколичественных оценках концентрации пользуются терминами: разбавленный, насыщенный = рассол или пересыщенный растворы. К большинству водных растворов применимы правила:1. В 1 мл – 20 капель, то есть объем капли ~50 мкл. 2. Объем чайной ложки – 5 мл, десертной – 10 мл, столовой – 15 мл. При количественном подходе, обычно используют массовые, молярные или объемные доли вещества, относительно общего количества системы. Согласно Международной системе единиц (СИ), допустимы лишь массовые (г/м3) и молярные (моль/м3) концентрации и их производные. Но, в обиходе, они слишком велики, трудоемки и неудобны, так как требуют пересчетов, специального оборудования и навыков работы. Поэтому, во всех допустимых случаях лабораторной и фармацевтической практики, применяют технически более простые и удобные объемные доли: г/л, ммоль/л, г/дл, мг/мл и т.п. При титриметрии пользуются более редкими величинами выражения концентраций: «титр» и «нормальность» (н.), отражающими, соответственно, количество граммов растворенного вещества в 1 мл или число химических эквивалентов растворенного электролита в 1 л. раствора. В быту и технике часто приемлемы более грубые, но технически простые и быстрые приемы выражения концентраций в процентах (%) или промилле (‰), соответственно массовой или объемной доле на 100 или 1000 мл раствора. Наконец в гомеопатии, концентрации растворов часто выражают долями на млн-1, трлн-1 и т.д., вплоть до числа Авогадро. Из схемы (рис. 3.2) следует, что кроме общеизвестных методов качественного и количественного анализа, современная биохимия и молекулярная биология применяет и другие подходы.
Рис. 3.2. Характеристика типов анализа в биологии и медицине
Известно, что качественный анализ основан на органолептических свойствах выявляемых компонентов, исходя из которых различают: внешний вид и запах вещества, выделение пузырьков газа, изменения цвета = цветные реакции, появление осадков в растворе = осадочные реакции, звуковой сигнал металлодетектора, изменения цвета пламени и т.п. Его классический пример – закрепившийся в органической химии способ описания веществ, начиная с их внешнего вида и физических свойств. Техническая простота и Экспрессность качественного анализа, часто допускают его применение как в лабораториях, так и на месте (on site), то есть в быту и полевых условиях. Примером этого, может быть оценка качества шерсти по запаху серы подожженной нити. Простые и дешевые приемы качественного анализа образцов в сжатые сроки, без предварительной подготовки проб, легли в основу методологии массового скрининга = просеивания (screen, англ. – сито). Такая экспресс-оценка полезна не только при металлодетекции, но и для выявления наследственных болезней у новорожденных, изучения токсичности и экологической безопасности образцов атмосферы, почв, воды, пищевых продуктов, косметики, бытовых изделий и т.д. Методы скрининга должны полностью исключать отрицательные результаты химико-биологических тестов, которые считают окончательными без дополнительной проверки. Напротив, все пробы с положительной реакцией, в т.ч. и ложноположительной, изучают далее, с помощью более информативных методов количественного анализа. Количественный анализ гораздо более трудоемок, так как связан с правильным выполнением технически громоздких операций подготовки образцов, применением мерной посуды, аналитических весов, рН-метров, фотометров и других сложных и сравнительно дорогих приборов. Понятно, что все эти требования выполнимы, лишь при наличии квалифицированного персонала и условий стационарной лаборатории. Тем не менее, в настоящее время, до 90 % полезной информации в экологической, медико-санитарной, сельскохозяйственной и судебной диагностке, получают с помощью аппаратурных методов количественного анализа. Часть этих методик осваивается при дальнейшем прохождении курса. Меньше известен, издавна популярный в медико-биологических науках, полуколичественный анализ. Как и количественный, он основан на какой-либо качественной реакции, интенсивность которой пропорциональна содержанию искомого вещества. Как правило, он не позволяет оценить его абсолютное содержание, но, наличие или возможность самостоятельного построения шкалы сравнений, делают этот способ технически приемлемым, относительно экспрессным и довольно экономичным, позволяя быстро оценивать серии образцов по принципу больше/меньше. Простейший пример полуколичественного анализа – универсальная индикаторная бумага, позволяющая быстро и просто получить примерный ответ о величине рН исследуемого раствора. 3.2. Дополнительная литература 3.2.1. Золотов Ю. А. Тест-методы // Ж. аналит. Химии, 1994. – Т. 49, № 2. – С. 149 - 157. 3.2.2. Евгеньев М. И. Тест-методы и экология // Соросовский образовательный журнал, 1999. – №11. – С. 29-34. 3.2.3. Максимовский Л. Ф., Микичур Н. И. Методы микроманипуляций и ультрамикроанализа в биологии и медицине. – Новосибирск.: Наука, 1989. – 236 с. 3.2.4. Хиллман Г. Определенность и неопределенность в биохимических методах. – М.: Мир, 1975. – 160 с. 3.2.5. Геккелер К., Х. Экштайн Аналитические и препаративные лабораторные методы. – М.: Химия, 1994. – 416 с. 3.2.6. Манниатис Т. и др. Молекулярное клонирование. – М.: Мир, 1984. – 480 с. Экспериментальная часть 3.3.1. Демонстрация пластиковых микропробирок и многолуночных планшетов для поточного анализа. 3.3.2. Перед работой с полуавтоматическим дозатором уяснить, что: 1. Они предназначены для высокоточного дозирования объемов биожидкостей и растворов реактивов, с предельной вязкостью < 1,3 х 10 -3 Па, не содержащих концентрированных кислот, щелочей и органических растворителей. 2. Дозаторы выпускают в одно- и восьмиканальных вариантах фиксированного и переменного = регулируемого объема, но в любом случае, предельный объем дозы указан на корпусе прибора. 3. Установку объема номинальной дозы в дозаторах переменного объема, проводят под контролем цифрового счетчика в корпусе прибора, осторожным (без усилия) вращением операционной кнопки в нужную сторону. 4. Действие дозаторов основано на плавном механическом перемещении калиброванного плунжера, герметично уплотненного в камере штуцера, попеременно создающего в съемном наконечнике вакуум или избыточное давление. Порядок работы: 5. Выбрав дозатор нужного объема, взять его за рукоять так, чтоб ее выступ оперся на указательный палец. 6. До упора надеть на штуцер дозатора сменный наконечник. 7. При отборе жидкостей в наконечник держать дозатор вертикально, не допуская их затекания в механизм прибора. 8. Постепенно нажать большим пальцем на операционную кнопку дозатора до первого упора. 9. Погрузив наконечник дозатора в раствор ~ на 5 мм, медленно отпустить кнопку и выждать 5-10 с. 10. После равномерного заполнения наконечника нужным объемом жидкости, снять ее излишки о край емкости. 11. Переместить наконечник дозатора в нужную пробирку или лунку планшета и, плавно нажав его кнопку до второго упора, выпустить в нее объем раствора. 11. Промыть наконечник тем же раствором, набирая и выпуская его несколько раз. 12. Сбросить одноразовый наконечник с дозатора в стакан со спецраствором для грязных наконечников. 13. Поместить дозатор в исходное положение.
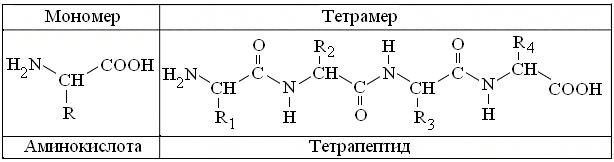
3.3.3. Сравнительный качественный анализ аминокислот и белков Известно, что все 20 разновидностей канонических α-аминокислот имеют однотипную структуру, с тремя вариантами функциональных групп (рис. 3.3). К сожалению, реакции на амино- и карбоксигруппы малоспецифичны, т.к. соответственно, свойственны всем аминам, ряду амидов и карбоновых кислот. То же относится и к большинству их радикалов = R, 10 из которых неполярны, то есть представлены алифатическими = углеводородными группами, большинство которых химически инертно. Относительно низка и специфичность большинства R полярных аминокислот, в которых встречаются спиртовые (Сер, Тре, Тир) амидные (Асн, Глн) и карбоксигруппы (Асп, Глу). Более активны аминогруппа (Лиз), имидазол Гис и гуанидиногруппа Арг, а максимальна активность тиогруппы Цис. Поэтому наибольшее практическое значение в качественном и количественном анализе α-аминокислот, в том числе и в аминокислотных анализаторах, получила универсальная нингидриновая реакция, специфичная для одновременного присутствия у α-С атома, как амино-, так и карбоксигруппы.
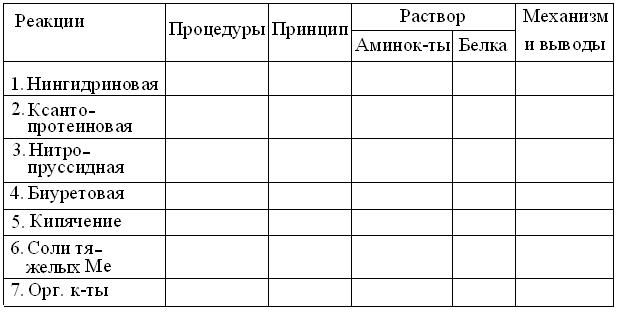
Рис. 3.3. Общие формулы структуры α-аминокислот и продукта их полимеризации. Пояснения в тексте. Полимеризация α-аминокислот в структуру пептидов и белков (рис. 3.3) сохраняет все типы их R, но: 1. Нингидриновая реакция становится отрицательной, т.к. за исключением N- и C-концевых, α-амино- и α-карбоксигруппы расходуются на образование пептидных связей. Положительная нингидриновая реакция с белком, скорей свидетельствует о присутствии примесей аминокислот в препарате или посуде. 2. Для всех пептидов и белков специфична биуретовая реакция на пептидную группу, отсутствующую в мономерных аминокислотах. 3. Из более специфических реакций на R аминокислот, бывают полезны: ксантопротеиновая реакция с концентрированной азотной кислотой, на ароматические R Фен, Тир, Три; реакция с изатином на пятичленный цикл Про, а также реакции на имидазольный R Гис, тиогруппу Цис и гуанидиногруппу Арг. Важно учитывать, что часть этих R скрыта внутри белковых глобул и потому, качественные реакции на них ослаблены. Поэтому, перед их проведением, белки обычно денатурируют тем или иным способом. 4. В отличие от истинных растворов аминокислот, коллоидным растворам белков свойственны осадочные реакции, связанные с разрушением их гидратных оболочек и, вследствие этого, снижением их растворимости под действием водоотнимающих средств: нейтральных солей = высаливание, метанола = МеОН, этанола = EtОН, ацетона, мочевины и др. агентов. Выполняя качественные реакции, следует: 1. Тщательно соблюдать правила пожарной безопасности и работ с концентрированными кислотами и щелочами = ЕЖ. 2. Промаркировать стеклографом или фломастером 2 ряда пробирок и поместить в один из них не более 0,5 мл (2-5 капель) 1 % раствора аминокислоты, а в другой – примерно тот же объем 1 % раствора белка. 3. В пару пробирок с растворами аминокислоты и белка, параллельно добавить по 3-5 капель соответствующих реактивов и, провести остальные процедуры, указанные для соответствующей реакции. 4. При необходимости нагрева пробирок – снять крышку тигля и поджечь спичкой сухое горючее. Затем, зажать пробирку в держатель, примитивная конструкция которого, очень ненадежна. Поэтому лучше обернуть пару пробирок сложенным в полоску листком бумаги и, придерживая их большим пальцем, равномерно пропускать нижние половины пробирок через пламя, избегая направления горлышек на соседей и бурного вскипания раствора. Выполнив операцию, своевременно погасить пламя крышкой тигля. 5. Результаты опытов, в соответствии с шаблоном, оформлять на развороте лабораторной тетради в виде таблицы:
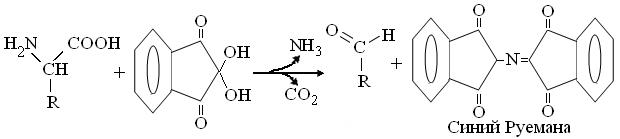
6. Обдумав полученные результаты и, завершив оформление протокола, вместе со штативом пробирок, предъявить их преподавателю для защиты. 1. Нингидриновая реакция.Основана на дезаминировании и декарбоксилировании α-аминокислот спиртовым раствором нинги-дрина:
Возникший аммиак, реагируя с двумя молекулами нингидрина, образует окрашенное производное, с максимумом поглощения при 540 нм (для Про – 440 нм). Ход работы: К исследуемым образцам добавить по 3-5 капель 0,5 % спиртового раствора нингидрина. Пробирки со смесями аккуратно прогреть на пламени и через 2-3 мин зарегистрировать появление окраски. 2. Ксантопротеиновая реакция. Как уже сказано выше, основана на образовании нитропроизводных аминокислот с ароматическим R: Фен, Тир, Три. Ход работы: Включив тягу вытяжного шкафа, в пару пробирок с исследуемыми растворами осторожно добавить по нескольку капель концентрированной азотной кислоты (HNO3). Пробирки аккуратно прогреть на пламени, избегая направления горлышек на соседей, и зарегистрировать развитие окраски. 3. Нитропруссидная реакция.Основана на щелочном гидролизе серусодержащей аминокислоты цистеина, с выделением сульфида натрия (Na2S), дающего со свежеприготовленным раствором нитропруссида натрия, комплекс красного цвета.
Ход работы: В обе пробирки с 5-10 каплям исследуемых растворов добавить равный объём 20 % едкого натра и прокипятить не менее 3-5 мин. Добавить в пробирки по 3-5 капель раствора нитропруссида натрия и зафиксировать развитие окраски. 4. Биуретовая реакция. Основана на образовании в щелочной среде цветного комплекса пептидной связи с ионом Cu2+. Служит универсальным тестом для выявления пептидов и белков в растворах. Так как с ростом количества пептидных связей, интенсивность окраски раствора линейно нарастает, широко применяется для фотометрического определения концентраций белка. Ход работы. В пробирки с 5-10 каплями исследуемых растворов добавить столько же 10 % раствора едкого натра. Хорошо перемешать и добавить по 2 капли 1 % раствора сульфата меди (CuSO4). Пробы перемешать и через несколько минут зарегистрировать развитие окраски. 5. Проба с кипячением.Основана на тепловой денатурации белков. Ход работы. Обе пробирки с исследуемыми растворами подкислить, не более, чем одной каплей 1 % раствора уксусной кислоты (AcOH) и нагреть до кипения. Прокипятив растворы 2-3 мин, зарегистрировать результаты и объяснить механизм явления. 6. Осаждение солями тяжелых металлов(Ме).Их денатурирующие свойства основаны на способности катионов тяжелых Ме реагировать с функциональными группами R молекулы белка: тио-, амино-, карбокси-, ароматическими. Также, их сильные анионы вызывают перезарядку ионогенных групп в молекулах белков, разрушая в них тем самым, ионные связи. Ход работы. В обе пробирки с исследуемыми растворами добавить по нескольку капель 5 % раствора сульфата меди (CuSO4). Зарегистрировать и объяснить полученные результаты. 7. Осаждение органическими кислотами.Основано на кислотной денатурации белков и образовании ковалентных производных тио-, амино- и ароматических групп R аминокислот с хлорорганикой. Ход работы. В пробирки с исследуемыми растворами добавить по нескольку капель 10 % раствора трихлоруксусной кислоты (ТХУ) и, через несколько минут зарегистрировать результаты. Вопросы для самоконтроля 3.4.1. Что такое «растворы» и как их можно классифицировать? 3.4.2. От чего зависят свойства водных растворов? 3.4.3. Какие вещества растворяются в воде? 3.4.4. Чем различаются растворение низкомолекулярных веществ и биополимеров? 3.4.5. Как влияют размеры растворенных частиц на свойства растворов? 3.4.6. В чем смысл деления растворов на электролиты и неэлектролиты? 3.4.7. Какие способы оценки концентрации растворов вы знаете? 3.4.8. Какие типы биохимического анализа вам известны и чем они различаются? 3.4.9. Что такое скрининг, на чем он основан и для чего применяется? 3.4.10. Чем различаются полуколичественный и количественный анализ? 3.4.11. Как устроены и зачем нужны полуавтоматические дозаторы объема? 3.4.12. Какие правила охраны труда нужно выполнять при проведении качественных реакций? 3.4.13. Расскажите о специфических качественных реакциях на аминокислоты и белки. 3.4.14. Укажите известные вам цветные и осадочные реакции на аминокислоты и белки. 3.4.15. Как обнаружить аминокислоты и белки в образцах? 3.4.16. Можно ли предположить, по аналогии, с аминокислотами и белками, существование качественных реакций для мономеров и полимеров других классов биомолекул?
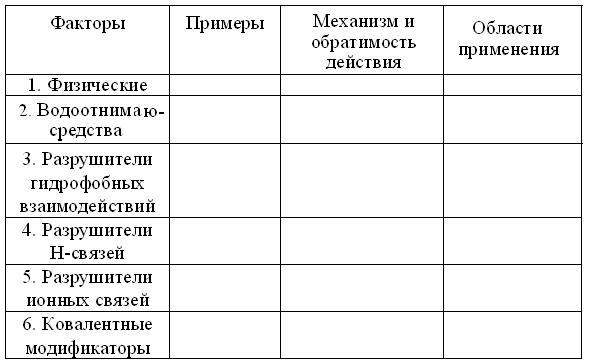
Задание на дом 3.5.1. Объясните, чем различаются понятия «аминокислоты», α-аминокислоты и «протеиногенные» аминокислоты? 3.5.2. По каким признакам стоит классифицировать α-аминокислоты? 3.5.3. Как соединяются α-аминокислоты в пептидах и белках? 3.5.4. Что вы знаете о номенклатуре пептидов? 3.5.5. Объясните термин «код» и подумайте, какие коды в биохимии вам известны? 3.5.6. Откуда возникла потребность в кодах аминокислот? 3.5.7. Запишите брутто-формулы и оцените растворимость каждой, из нижеследующих пар пептидов: 1. (Гли)20 и (Глу)20 при рН 7,0; 2. (Лиз-Ала)3 и (Фен-Мет)3 при рН 7,5; 3. (Ала-Сер-Гли)5 и (Ала-Сер-Гис)5 при рН 9,0; 4. (Ала-Асп-Гли)5 и (Асн-Сер-Гис)5 при рН 3.0. 3.5.8. Попытайтесь составить функциональную классификацию внутри- и внеклеточных пептидов. 3.5.9. Чем различаются структура, свойства и биологическая роль пептидов и белков? Почему разнообразие белков гораздо больше, чем у пептидов? 3.5.10. Какие виды гидролиза белков Вам известны? 3.5.11. Определите понятия денатурация и ренатурация = ренативация белков. Чем они отличаются от гидролиза? Расскажите об известных вам признаках и условиях осаждения белков из растворов. 3.5.12. Если изоэлектрическая точка = ИЭТ пепсина лежит при рН 1, то какие функциональные группы R и, каких именно аминокислот, могут обеспечить это свойство? 3.5.13. Какие функциональные группы и, каких именно аминокислот, нужны протаминам и гистонам, чтоб обеспечить ИЭТ > 10? 3.5.14. Исходя из структуры белков объясните, почему при «горячей» стирке и сушке, изделия из шерсти «садятся», а из шелка – нет? 3.5.15. Можно ли считать основой биоразнообразия, видоспецифичность множества гомологичных белков? 3.5.16. В соответствии с предложенным шаблоном, заполните таблицу факторов и механизмов денатурации:
|
|