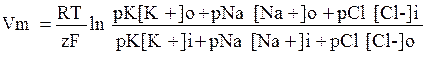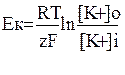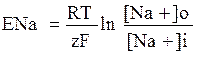|
|
Работа 4. Вычисление цветного показателя
Цветным показателем (ЦП) называют отношение количества гемоглобина к числу эритроцитов. Если в крови содержание гемоглобина равно 100 % и количество эритроцитов в 1 мм3 составляет 5 млн., то ЦП принимается равным единице. Вычисление производим по формуле:
Рассчитываем значение ЦП. Записываем полученный результат. Физиологические константы системы крови
Литература: Основная: 1. Физиология человека: В 3 т. / Под ред. Р. Шмидта и Г. Тевса. М., 1996. Т. 2 С. 414–453. 2. Общий курс физиологии человека и животных: В 2 т. / Под ред. А.Д. Ноздрачева. М., 1991. Т. 2 С. 123–178. Дополнительная: 3. Базисная и клиническая фармакология. Под ред. Б. Катцунга. СПб., 2000. 4. Иммунология. Под ред. А. Ройта. М., 2000. 5. Методы клинико-лабораторных исследований. Под ред. В.С. Камышникова. Минск: Белорусская наука, 2001. – 695 с. 6. Пособие для врачей-лаборантов по методу определения гемоглобина. М., 2002. –20 с. 7. Справочник «Медицинские лабораторные технологии»: В 2-х т. С.-Петербург: «Интермедика», 2002. Т. 1. – 408 с. 8. Физиология системы крови. Физиология эритропоэза. Под ред. В.Н. Черниговского. Л., 1979. 9. Долгов В.В., Луговская С.А., Морозова В.Т., Почтарь М.Е. Лабораторная диагностика анемий. 2-е изд. М., Тверь: ООО Изд- во «Триада», 2009. – 148 с. 10. Заварзин А.А. Очерки эволюционной гистологии крови и соединительной ткани. М., 1945. 11. Камышников В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике. М.: Медпресс-информ, 2004. – 920 с. 12. Луговская С.А., Морозова В.Т., Почтарь М.Е., Долгов В.В. Лабораторная гематология. М.: изд-во ЮНИМЕД-пресс, 2002. – 120 с. 13. Лысенко А.Я. ВИЧ-инфекция и СПИД-ассоциируемые заболевания. М., 1996. 14. Михайлов В.В. Основы патологической физиологии: Руководство для врачей. М., 2001. 15. Усов И.Н., Чичко М.В., Астахова Л.Н. Практические навыки педиатра. Минск: «Вышэйшая школа», 1990. – 400 с.
II. ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ Занятие 1. ФИЗИОЛОГИЧЕСКИЕ СВОЙСТВА НЕРВОВ И МЫШЦ Контрольные вопросы 1. Раздражение, раздражители. Возбуждение и формы его проявления. 2. Параметры возбудимости: порог силы, порог времени, минимальный градиент. Закон силы –длительности. 3. Законы раздражения возбудимых тканей. 4. Строение и функции мембран возбудимых клеток. 5. Мембранный потенциал, ионный механизм его формирования. 6. Фазы и механизмы развития потенциала действия. 7. Изменение возбудимости в процессе возбуждения. Рефрактерность.
Элементы физиологии клетки Одной из существенных характеристик животной клетки является ее способность активно реагировать на действие специальных факторов окружающей среды. Реактивность клеток проявляется в их раздражимости. Раздражимость – это способность живых систем реагировать на действие факторов внешней среды и отвечать на него той или иной формой своей специализированной деятельности. Возбудимость – это способность клетки переходить из состояния относительного покоя в состояние возбуждения при действии раздражителя. Клетки, способные к возбуждению – мышечные, железистые и нервные, называют возбудимыми. Возбудимыми могут называться и отдельные элементы клеток, например, рецепторы. В узком смысле термина возбудимыми клетками можно назвать те, в плазмолемме которых имеются активные потенциалзависимые ионные каналы, способные при определенных условиях (достижении критического уровня деполяризации) переходить из закрытого в открытое состояние и обеспечивать формирование потенциала действия. В физиологии свойство возбудимости не ограничивают клетками, а распространяют на ткани, подразделяя их на возбудимые и невозбудимые. Можно считать возбудимыми такие ткани, клеточные структуры которых обладают возбудимыми, укомплектованными потенциал-зависимыми каналами, мембранами [В.О. Самойлов, 2002]. К ним относят железистую, нервную и мышечную ткани. Только в них под действием раздражителей возникают потенциалы, отражающие генерацию ПД отдельными клетками. Энергия для перехода из состояния покоя в состояние возбуждения запасается в самой клетке (метаболизм, работа ионных насосов, направленная на создание ионных градиентов). Раздражитель выступает только как стимул, стартовый толчок. Системы активного транспорта ионов (ионные насосы, ионные помпы) обеспечивают неравновесное распределение ионов между клеткой и межклеточной средой, а также между цитозолем и органеллами. Стабильное поддержание ионного неравновесия, а также перемещение ионов через клеточные мембраны в сторону более высокого электрохимического потенциала для осуществления многих физиологических процессов обеспечивается работой ионных насосов. К настоящему времени хорошо изучены особенности функционирования калий-натриевой помпы. Ее компонентами являются АТФ (возобновляемый источник энергии) и натрий-калий-активируемая АТФаза (сокращенно - Na-K-АТФаза), которая служит одновременно переносчиком ионов. Калий-натриевая помпа локализована на мембранах практически всех клеток организма, но относительно много молекул – насосов имеется там, где осуществляется особенно интенсивный транспорт ионов, например, в почечных или кишечных эпителиоцитах или в мембранах электровозбудимых клеток. Количество молекул и активность Na-K-АТФазы в разнообразных клетках находится под гормональным контролем (тироксин, альдостерон) [68]. Еще одним представителем ионных насосов, выполняющим исключительно важную роль, является кальциевый. В клетке ионам кальция принадлежит не только электрогенная, но и регулирующая роль. По этой причине необходимо строго регулировать внутриклеточную их концентрацию. Кальциевый насос поддерживает содержание ионов Са++ в цитозоле на низком уровне. В качестве депо кальция выступают митохондрии и цистерны эндоплазматического ретикулума. Их мембраны и содержат кальциевый насосный механизм. Среди интегральных белков плазматической мембраны имеется несколько семейств, выполняющих функции ионных каналов. Некоторые из них являются высокоизбирательными для определенных ионов, их относят к классу селективных (например, только для иона натрия или калия). Другие способны переносить только или катионы, или анионы (ионы хлора). Ионные каналы могут находиться в открытом или закрытом состоянии, в зависимости от способа активации и общего заряда клеточной мембраны. Перемещение катионов и анионов через поры каналов происходит по градиенту их концентрации (концентрационному градиенту) или по градиенту потенциала (электрохимическому градиенту). По способу активации выделяют [35, 64]: 1. потенциал-активируемые ионные каналы (переход из закрытого в открытое состояние и обратно осуществляется конформацией белковой молекулы при изменении потенциала мембраны). Примером может служить потенциал-зависимый натриевый канал, определяющий деполяризацию клетки при генерации потенциала действия. 2. механочувствительные ионные каналы (открываются при воздействии на мембрану клетки механического стимула, например, при активации механорецепторов кожи или волосковых клеток органа слуха). 3. лиганд-активируемые ионные каналы. По способу активации они, в свою очередь, подразделены на две группы (экстраклеточные и внутриклеточные) в зависимости от того, с какой стороны мембраны воздействует лиганд. Если стимул (например, ацетилхолин) при осуществлении синаптической передачи возбуждения в нервно-мышечном синапсе действует на рецептор (в данном примере холинорецептор, представляющий собой одну из нескольких белковых субъединиц ионного канала), расположенный на внешней поверхности мембраны мышечной клетки, откроется ионный канал, проницаемый для катионов. Если лиганд-активируемые каналы зависят от вторичных посредников в клетке, их переход в открытое состояние осуществляется при изменении концентрации определенных ионов в цитоплазме. Примером может служить кальций-активируемый калиевый канал, активирующийся при увеличении концентрации ионов кальция в клетке. Такие каналы принимают участие в реполяризации мембраны при завершении потенциала действия. Описано несколько типов потенциалзависимых натриевых каналов в плазматических мембранах. Они представляют собой белковые молекулы, состоящие из нескольких, чаще всего четырех субъединиц и нескольких доменов, несущих в зависимости от преобладания тех или иных аминокислотных остатков сильный положительный или отрицательный заряд, и функционирующих как селективный фильтр или сенсор напряжения. Современные учебники при описании «воротного механизма» таких каналов не приводят сведений о существовании «легких» m или «тяжелых» h ворот. Скорее всего, функцию перевода канала из закрытого в открытое состояние осуществляет «сенсор напряжения» – несущий положительный заряд участок аминокислотной последовательности, состоящей преимущественно из лизиновых и аргининовых остатков. Среди действующих на рецептирующую клетку физиологических стимулов ключевую роль играют сдвиги мембранного потенциала, что и предопределяет активацию потенциалзависимыхионных каналов. Сенсор напряжения натриевого канала способен реагировать на сдвиг мембранного потенциала от уровня потенциала покоя (примерно 90 мВ) до –55 мВ, т. е. порог активации (перевода канала из закрытого в открытое состояние) составляет около 35 мВ. Обсуждаются также возможные механизмы инактивации каналов, основанные на альтернативных классическим подходах (модель «шар на веревочке»). Согласно упомянутой модели, инактивация потенциал-зависимого канала может осуществляться перекрытием его устья одним из четырех гибких цитоплазматических окончаний канальной субъединицы, состоящих из 45 аминокислотных остатков. Клетки, нервные и мышечные, располагают большим разнообразием кальциевых каналов. Среди них описаны потенциал-независимые (лиганд- или рецептор-управляемые). Наряду с этим известно семейство потенциалзависимых кальциевых каналов, обозначаемых литерами L, T, Р, Q, N, R. В мембранах различных клеток имеется свой, совсем не совпадающий с другими клетками, репертуар потенциал-управляемых ионных каналов. В мембране гигантского аксона кальмара присутствуют главным образом натриевые и калиевые каналы. В сарколемме поперечно-полосатого мышечного волокна они дополняются популяцией кальциевых каналов. Кальциевых каналов значительно больше в плазмолемме кардиомиоцита, а в мембране гладкомышечного волокна они вообще преобладают. Соотношением каналов разных типов в плазматической мембране той или иной клетки определяются параметры генерируемых ими потенциалов действия. Однако главное, что определяет наличие в плазмолемме потенциалзависимых каналов – отнесение обладающих ими клеток к категории электровозбудимых. Способность возбудимой ткани изменять свои свойства или состояние под действием раздражителей называют возбудимостью. Таким образом, все клеточные мембраны делят на возбудимые (электрогенные) и невозбудимые (неэлектрогенные). Невозбудимые мембраны способны генерировать только потенциалы покоя, в то время как возбудимые – и ПП, и ПД. Указанное различие обусловлено присутствием в возбудимых мембранах потенциалзависимых ионных каналов. В невозбудимых мембранах находятся только потенциал-независимые ионные каналы. Сегодня известно, что основной вклад в формирование потенциала покоя и потенциала действия вносят четыре иона. Na+, K+ , Ca++, Cl– способны либо проникать, либо не проникать в определенных условиях через соответствующие ионные каналы. При потенциале покоя внутренняя сторона клеточной мембраны имеет заряд, знак которого (отрицательность) определяется наличием в цитоплазме органических анионов (белков и аминокислот, например, аспартата или глутамата), неспособных проникать через ионные каналы, и дефицитом их противоионов – катионов калия, способных проникать через «дежурные» калиевые ионные каналы. Из-за этого в клетке наблюдается избыток отрицательных ионов, и, следовательно, отрицательных зарядов, а в интерстиции – избыток положительного заряда. Величину отрицательного заряда в клетке и положительного заряда в межклеточном пространстве удается предсказывать математически, но лишь для простых случаев, например для гигантского аксона кальмара или глиальной клетки. Величина потенциала покоя описывается с известным приближением уравнением постоянного поля, предложенным Ходжкиным, Гольдманом и Катцом. Приводится упрощенный вид уравнения:
Здесь R – газовая постоянная, T –температура, z – заряд иона, а F – константа Фарадея. Литерой p обозначается проницаемость иона. Чтобы знать направление и количество перемещенных катионов и анионов, обусловливающих существование трансмембранных токов, текущих в данных условиях через ионные каналы плазмолеммы, электрофизиологи вычисляют и измеряют мембранный потенциал, равновесный потенциал и потенциал покоя. Мембранный потенциал задается суммой действующих по обе стороны мембраны зарядов, носителями которых выступают конкретные ионы, способные проникать через ионные каналы. Это физический потенциал цитозоля относительно интерстиция, поддающийся измерению (микроэлектродом, соединенным с входом усилителя) в реальном опыте. Равновесный потенциал – такой потенциал плазмолеммы клетки, при котором суммарный ток конкретного иона через мембрану равен нулю, несмотря на возможность отдельных ионов проникать через открытые каналы в обмен на такие же ионы, следующие в противоположном направлении. Определяется уравнением Нернста. Равновесный потенциал для иона калия
и натрия
зависит, как видим из формул, прежде всего от их концентраций, поскольку заряды z= 1 для обоих ионов, а константы R – газовая постоянная, Т – абсолютная температура и число Фарадея F для любых ионов одинаково. Сравнение ПП и равновесного потенциала для конкретного иона позволяет понять и предсказать, куда будет направлен вектор его ионного тока при данном значении мембранного потенциала. Ток иона натрия при генерации ПД будет направлен в клетку по градиенту концентрации и электрохимическому градиенту. Он зависит от уровня поляризации мембраны, или от реального мембранного потенциала Vm, проводимости для натрия gNa и равновесного натриевого потенциала ENa, т. е. концентрации натриевых ионов по обе стороны мембраны. Определяется выражением
iNa = gNa (Vm – ENa), где gNa = 1/R – проводимость, величина, обратная электрическому сопротивлению, измеряется в сименсах. Выражение в скобках называется движущей силой для ионов. Ток ионов калия при реполяризации плазмолеммы iК = gК(Vm–EК) направлен из цитозоля в межклеточное пространство, если Vm меньше EК и существует до тех пор, пока их значения не уравняются. Наоборот, если клетка гиперполяризована, Vm > EК и ионы калия будут стремиться входить в клетку против концентрационного градиента до достижения равновесия. В учебниках указывается, что равновесные потенциалы при физиологических значениях концентраций ионов по обе стороны плазматической мембраны для важнейших электрогенных ионов в большинстве клеток приблизительно соответствуют: Ек = –75 мВ; ЕNa = +55 мВ; ЕCa = +150 мВ; ЕCl = –80 мВ. В состоянии покоя величина мембранного потенциала аксонов примерно наполовину зависит от распределения относительно мембраны ионов K+. С точки зрения законов биофизики это означает, что равновесный калиевый потенциал Ек по своей величине и знаку ближе всего соответствует мембранному ПП. Вместе с тем свой вклад в ПП различных возбудимых клеток вносит натриевая и хлорная проводимость (например, в экстрафузальных мышечных волокнах и окончаниях первичных афферентных волокон в вершине дорсального рога спинного мозга), а также Na+ – K+ ионный насос. При генерации потенциала действия решающий вклад в него вносит поток ионов натрия (в аксоне) или натрия и кальция (в дендритах нейронов и кардиомиоцитах, гладких миоцитах), направленный внутрь клетки. И прямыми методами измерения, например, используя фиксацию напряжения, и косвенными, с использованием специфических канальных блокаторов, тетродотоксина и тетраэтиламмония, удалось показать, что при возбуждении проницаемость для ионов натрия на время, равное нескольким миллисекундам (этот период соответствует продолжительности потенциала действия) резко возрастает, а затем снова падает. В результате баланс катионов (Na+) и анионов (С1–, НСО–з) на внешней поверхности плазмолеммы изменяется (нарушается эквипотенциальность): Na+ по открывшимся потенциалзависимым каналам входит в цитоплазму, а анионы – нет. Поток натрия «уносит» с собой положительный заряд в цитозоль. Возникает «овершут» (или инверсия мембранного потенциала). Необходимо подчеркнуть то обстоятельство, что явление овершута в этом процессе имеет значение только при расположении регистрирующего электрода внутри клетки. В случае экстраклеточной электрографии важнее уяснить, что в тот момент, когда ионы натрия вошли в клетку при генерации ПД, в интерстиции возник их дефицит, определяющий временное уменьшение положительного заряда – кратковременную электроотрицательность. Такую же электроотрицательность при возникновении потенциала действия создает и дефицит ионов кальция в межклеточном пространстве, если они устремились в клетку, например, гладкомышечную. Носителями отрицательного заряда в этих случаях выступают низкомолекулярные анионы интерстиция, прежде всего Сl– и бикарбонат НСО–з. Сумма электроотрицательных зарядов обеспечивает существование внеклеточных токов, текущих к участку возбуждения от невозбужденных сегментов клетки, доступных для приборного обнаружения при регистрации электронейрограмм, электрокардиограммы, электромиограмм и электроэнцефалограммы. Восстановление исходного баланса катионов по обе стороны плазмолеммы обеспечивается открытием дополнительно новой популяции калиевых каналов. В электрофизиологических опытах обнаружено, что после кратковременного повышения натриевой проводимости величина мембранного потенциала почти сразу восстанавливается до первоначального уровня потенциала покоя. Оказалось, что в этом процессе существенна роль потенциал-активируемых калиевых каналов, которые обусловливают реполяризацию мембраны за счет выхода из клетки какого-то количества ионов K+ как носителей положительного заряда. В нервных проводниках вся динамика потенциала действия и восстановление потенциала покоя обеспечивается в основном вкладом указанных катионов. ПД миоцитов связан с входящим в цитоплазму из интерстиция потоком не только Na+, но и Са++. В скелетных мышцах вкладСа++в ПД невелик, в миокарде он больше, в гладких мышцах доминирует. Последующая медленная «откачка» натрия из цитозоля взамен на калий обеспечивается калий-натриевой помпой, а кальция – кальциевым насосом. Быстрое повышение проницаемости мембраны для внеклеточных катионов, приводящее к генерации потенциала действия, обеспечивается существованием потенциалзависимых ионных каналов, способных при достижении КУД (порога) переходить из закрытого в открытое состояние (при условии их функциональной работоспособности). Вызвать возбуждение клеток и тканей можно, применив электрические стимулы. Если один электрод поместить внутрь клетки, а другой снаружи, и пропускать через цитоплазму ток, можно прямо смещать уровень мембранного потенциала и добиться появления потенциала действия (нервного импульса), при том условии, что ток будет выходящим, т. е. отрицательный электрод (катод) должен быть в интерстиции, а анод – в цитоплазме. Можно добиться возбуждения тканей и при электрораздражении их поверхностей. В этих условиях открытие потенциалзависимых ионных каналов будет наблюдаться под катодом. Электрические реакции клетки принято разделять на те, реакция которых не зависит от силы действующего раздражителя – неградуальные (потенциал действия) и те, которые пропорциональны силе действующего стимула – градуальные, пошаговые, (пример – локальный ответ). Градуальность характерна для тех клеток, или тем процессам в клетках, при которых не происходит активация потенциалзависимых каналов. Поэтому понятие градуальности применимо для всех невозбудимых клеток и тканей (у них вообще нет потенциалзависимых ионных каналов) и возбудимых в том случае, если все изменения мембранного потенциала не достигают критического уровня деполяризации КУД (все виды гиперполяризации и допороговая деполяризация). Если мы начнем рассматривать с позиций «пошаговой» классификации электровозбудимые ткани, то окажется, что электрические сигналы в них (суммарные) все-таки зависят от силы действующего раздражителя. Отдельные внеклеточные «импульсы», природа которых рассмотрена выше, в электрически сложной структуре, например нервном стволе или мышце, после прохождения по межклеточному пространству на разное расстояние (определяемое геометрией структур) способны интерферировать. Взаимное сложение и вычитание сигналов на поверхности регистрирующих электродов (вернее, взаимное сложение или вычитание токов, которые текут через входное сопротивление усилителя при регистрации) приводит к ситуации, при которой суммарный ток может быть меньше по величине в тех случаях, когда отдельные его составляющие (от разных волокон) поступают не одновременно. И, наоборот, при синхронном возбуждении многих проводников (нервных волокон или миоцитов) суммарный электрический внеклеточный потенциал оказывается выраженным сильнее. Ясно, что токи из глубины ткани не могут прямо достигать поверхности, где располагается отводящий электрод. Регистрируется в основном активность некоторого подмножества возбужденных единиц, находящихся в «электрически доступном» удалении от электрода. Однако сигналы на электродах и входе усилителя возникают только посредством электромагнитных полей, порождаемых отдельными токами, протекающими в интерстиции от невозбужденных к возбужденным участкам клетки. Применение спаренных стимулов с изменяющейся паузой между ними для раздражения клетки или целого нервного ствола, что технически проще, позволяет определить и другие важные характеристики возбудимости клеток. Если не закончилось полностью развитие предыдущего потенциала действия, второй стимул может и не вызвать импульс, если будет предъявлен слишком скоро после предыдущего. Период невозбудимости после предыдущего потенциала действия, как известно, называется рефрактерностью. Абсолютная рефрактерность, или полная невозбудимость электровозбудимой ткани, обусловлена тем, что в эту фазу все потенциал-управляемые каналы отдельных клеток, нейронов или миоцитов, уже «заняты» проведением ионного тока внутрь клетки и новых проводящих пор в мембране открыть нет возможности. Абсолютная рефрактерность (1 – 5 мс для нерва, около 300 мс для сердечной мышцы) продолжается весь период развития восходящей фазы или плато потенциала действия. Если повторный стимул приложить к клетке чуть позже, когда уже начнется реполяризация, на заднем фронте потенциала действия, в период инактивации потенциалзависимых каналов, ПД может и появиться, но при более высоком значении стимулирующего тока. Эта фаза называется относительной рефрактерностью. Продолжительность рефрактерных фаз обусловлена и разной инерционностью («канальной кинетикой») потенциалзависимых ионных каналов. После окончания фазы реполяризации в клетке могут наблюдаться следовые процессы – следовая деполяризация и следовая гиперполяризация. При следовой деполяризации возбудимость повышена, что явилось основанием для введения понятия «супернормальность», или экзальтация. ПП в это время приближен к КУД, что отражается в уменьшении порога возбуждения. Наоборот, при следовой гиперполяризации возбудимость понижена, ПП дальше от КУД, фаза субнормальности. Рефрактерность и следовые процессы определяют лабильность возбудимой ткани. Она определяется способностью нерва передавать определенную максимальную частоту потенциалов действия без ее искажения (трансформации ритма). Частота импульсов определяется скоростью изменений ионной проницаемости, которая, в свою очередь, зависит от продолжительности реактивации потенциалзависимых каналов (в аксонах — натриевых, в миоцитах — натриевых и кальциевых). Реально лабильность выше 1000 Гц не встречается, поскольку этой частоте соответствует длительность отдельных следующих друг за другом импульсов около 1 мс.
|
|