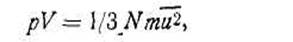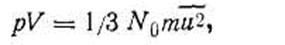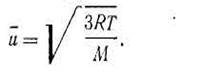|
|
Молекулярно-кинетическая теория газов.Основы молекулярно-кинетической теории газов, которая объяснила физический смысл газовых законов, были заложены еще в работах М. В. Ломоносова. В 1744—1748 гг. он разработал теорию атомно-молекулярного строения вещества, впервые обосновал кинетическую теорию теплоты и на основании этого объяснил многие неизвестные до него явления. В XIX в. молекулярно-кинетическая теория газов получила свое дальнейшее развитие в работах Клаузиуса, Максвелла и Больцмана. На новейшем ее этапе эта теория была в современном виде разработана Я. И. Френкелем. В основе кинетической теории идеальных газов лежат следующие простые допущения. Каждый газ 1) состоит из молекул, которые можно рассматривать как однородные абсолютно упругие шарики; причем размеры этих шариков-молекул настолько малы по сравнению с межмолекулярными расстояниями, что их можно рассматривать как отдельные материальные точки; 2) столкновение молекул между собой подчиняется законам удара упругих шаров; 3)молекулы не взаимодействуют друг с другом, пока не столкнутся; 4)движение молекул в газе хаотично, непрерывно, поступательно. Молекула в разные моменты времени обладает самыми разнообразными скоростями как по величине, так и по направлению. Поэтому трудно описать движение отдельной молекулы. Однако в целом к огромному количеству молекул вследствие беспорядочности их движения можно применять законы теории вероятности. Известно, что при множестве движущихся молекул (или атомов) число частиц, обладающих скоростью, лежащей в данном интервале значений, остается постоянным. Теоретические подсчеты, произведенные Максвеллом в 1860 г., показали, что молекулы газа по скоростям движения при данной температуре распределяются строго определенным образом. Молекулярно-кинетическая теория объяснила многие свойства газов, например стремление их занять возможно больший объем, давление на стенки сосуда, медленный характер процесса диффузии, рост давления с повышением температуры и др. Молекулы ударяются о стенки сосуда, создавая тем самым давление. Его мерой является сила ударов движущихся молекул о поверхность в 1 м2 в 1 с. С повышением температуры скорость движения молекул увеличивается, вместе с тем увеличивается и число ударов молекул о стенки сосуда, т. е. растет давление газа. В каждый отдельный момент молекула имеет разные скорости как по величине, так и по направлению, но для каждой постоянной средняя скорость движения молекул есть величина постоянная. Применяя к хаотическому движению молекул в газе законы механики, удалось получить основное уравнение, которое связывает объем и давление со средней квадратичной скоростью движения молекул газа:
где N — число молекул газа, находящихся в объеме V; m — масса одной молекулы данного газа. Для 1 кмоль газа можно записать основное уравнение
где N0 — постоянная Авогадро. Уравнение (I.24) называется основным, потому что из него можно математически вывести все рассмотренные выше законы идеальных газов, рассчитать кинетическую энергию молекулы, среднюю скорость движения молекул газа и ряд других важных следствий. Пользуясь основным уравнением (I.24), можно вывести простое соотношение, чтобы вычислить средние квадратичные скорости движения молекул различных газов для разных температур. При этом необходимо заменить произведение N0m равной ему молярной массой М: pV= l/3 Mu2,но РV= RT; RT= l/3Mu2, откуда
Из уравнения (I.25) следует, что средняя квадратичная скорость зависит от температуры и природы газа. Для данного газа при постоянной температуре является величиной постоянной и выражается в м/с. Так, для водорода, азота и кислорода средние квадратичные скорости молекул при 0° С соответственно равны 1845, 493 и 461 м/с. Для реальных газов уравнение Ван-дер-Ваальса будет
Уравнение Ван-дер-Ваальса значительно точнее отображает состояние реального газа, чем уравнение (I.17), которое было выведено для идеальных газов.
|
|