|
|
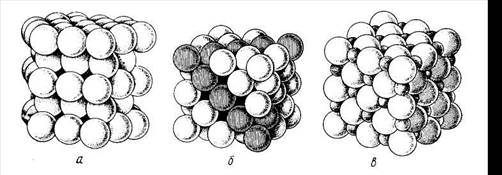
Внутреннее строение кристаллов и основные типы кристаллических решеток.Весьма тонкие современные методы исследования кристаллического состояния вещества подтвердили, что частицы в кристаллах (атомы, молекулы, ионы) располагаются закономерно, образуя так называемую пространственную решетку кристалла. Внешняя геометрическая форма кристалла теснейшим образом связана с его внутренней структурой. В кристаллической решетке любого тела можно выделить определенную часть, которая носит название элементарной ячейки. Она представляет собой наименьший объем кристаллической решетки вещества, который точно отражает его химический состав и все особенности внутренней структуры данного кристалла. Во внутреннем строении кристаллов выполняется принцип плотнейшей упаковки частиц, из которых состоит данный кристалл. Под действием сил взаимного притяжения частицы стремятся разместиться как можно ближе друг к другу. Поэтому наиболее энергетически выгодно такое взаимное расположение частиц в кристалле, которое отвечает их наиболее плотной упаковке. Промежутки между ними достигают минимума. При этом могут иметь место два случая. 1.Радиусы частиц, из которых состоит кристалл, равны или очень близки по величине. Этому условию отвечают два типа кристаллических решеток: гексагональная (рис. 1.1, а) и гранецентрированная кубическая (рис. 1.1, б). В таких решетках степень заполнения объема кристалла частицами составляет 74%. Это максимально плотная упаковка частиц одинакового или близких по величине радиусов. Подобный тип решеток свойствен большинству металлов. 2.Радиусы частиц, образующих кристаллы, сильно различаются.
Рис. 1.1 Различные типы кристаллической решетки
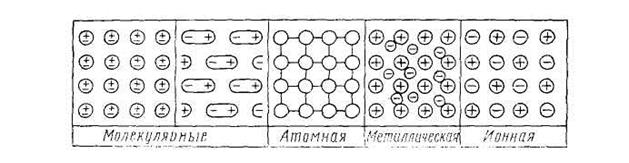
Принцип плотнейшей упаковки применим и в этом случае. Частицы более крупных размеров в основном образуют кубическую или гексагональную сетку, а более мелкие частицы занимают свободное пространство между ними. Этот тип решетки характерен для ионных кристаллов, поскольку разные ионы довольно резко отличаются друг от друга по радиусам; например, такова структура кристалла хлорида натрия (рис. 1.1, в). Следует отметить, что наряду с соотношением размеров частиц на структуру кристалла оказывают известное влияние и поляризационные взаимодействия между ними. С точки зрения структурных элементов и действующих между ними сил различают четыре типа кристаллов: молекулярные, атомные, ионные и металлические. Молекулярная решетка. Молекулярные кристаллы имеют в углах пространственной решетки полярные или неполярные молекулы, связанные между собой силами Ван-дер-Ваальса. В качестве примера можно указать на твердую двуокись углерода (сухой лед), нафталин, лед. На рис. 1.2 показано строение элементарной ячейки твердого диоксида углерода. Как видим, атомы углерода образуют кубическую решетку с центрированными гранями: атомы кислорода расположены по обе стороны от углерода на отрезках прямых, ориентированных определенным образом относительно ребер элементарной ячейки.
Атомная решетка. В узлах кристаллических решеток этого типа расположены нейтральные атомы, определенным образом ориентированные в пространстве и связанные ковалентными связями. К числу веществ с атомной решеткой относятся, например, кремний, графит, алмаз, бор и др. Ковалентная связь, как известно, очень прочная, поэтому все связи в кристалле равноценны и очень прочны. Вещества, образованные атомными решетками, имеют большую твердость, высокую температуру плавления, малую растворимость и малую летучесть. На рис. 1.3 приведены схемы строения атомных решеток алмаза и графита. В силу своеобразия структуры графит имеет очень малую прочность связи по плоскостям спайности кристалла, тогда как алмаз обладает огромной твердостью, поскольку все атомы углерода в его кристаллической решетке расположены друг от друга на одинаковом расстоянии. Ионная решетка. Ионные кристаллы имеют в узлах пространственных решеток положительно и отрицательно заряженные ионы, которые связаны между собой электростатическими силами притяжения разноименных зарядов. Силы взаимодействия в ионных кристаллах весьма значительны, благодаря чему вещества с ионным типом решетки обладают высокой прочностью, высокими температурами плавления и малой летучестью.
Металлическая решетка. Этот тип кристаллических решеток отличается от всех рассмотренных выше типов структур. Согласно современным представлениям, в узлах пространственной решетки типичных металлов в основном находятся положительно заряженные ионы, упакованные по принципу плотнейшей упаковки шаров, а в промежутках между ними находятся электроны в свободном состоянии. Последние образуют своеобразный «электронный газ», который как бы скрепляет одноименно заряженные ионы металла в плотнейшую кристаллическую решетку. Именно наличием свободных электронов объясняется хорошая электрическая проводимость и теплопроводность, а также многие химические свойства металлов. Металлы, как известно, от всех известных природных материалов отличаются высокой прочностью наряду с хорошей пластичностью как в холодном, так и в горячем состоянии. Высокая температура плавления металлов указывает на значительную прочность металлической решетки и также объясняется наличием «электронного газа» в нем. Под влиянием разности потенциалов электроны в металле начинают передвигаться в определенном направлении, что является причиной возникновения электрического тока.
Рис. 1.4 Плоскостные схемы кристаллических решеток различных типов На рис. 1.4 приведены плоскостные схемы всех рассмотренных типов кристаллических решеток. Однако, принимая такую классификацию кристаллов, всегда нужно иметь в виду, что характер разных связей даже в одном и том же кристалле может быть не одинаковым и классификационные признаки не всегда четко и хорошо выражены. Наряду с кристаллами, относящимися к одному из четырех рассмотренных видов связи, существуют кристаллы с различными переходными и смешанными формами связи. Это, например, целиком относится к кристаллогидратам, в которых встречаются одновременно ионный тип связи между катионами и анионами соли, ковалентная связь между атомами, входящими в состав аниона, а также полярные связи внутри молекул воды и ионодипольная связь молекул с ионами. Значительный интерес представляют кристаллы, образующие так называемые слоистые решетки, которые характерны для графита, слюд и глинистых минералов. |
|


 Поскольку силы взаимодействия между молекулами сравнительно слабы, то и вещества с данным типом решетки обладают малой твердостью, низкими температурами плавления и кипения. Растворы этих веществ, как правило, имеют сравнительно малую электрическую проводимость.
Поскольку силы взаимодействия между молекулами сравнительно слабы, то и вещества с данным типом решетки обладают малой твердостью, низкими температурами плавления и кипения. Растворы этих веществ, как правило, имеют сравнительно малую электрическую проводимость.
 Ионные решетки характерны для большинства неорганических соединений (соли, оксиды и другие классы соединений). Многие минералы также имеют ионное строение. Так, кристаллы, имеющие ионную решетку, как правило, хорошо растворимы в воде, а растворы их обладают высокой электрической проводимостью. В твердом виде ионные кристаллы не проводят электрический ток, так как в них электроны прочно удерживаются в атомных орбиталях отдельных ионов. В расплавленном состоянии кристаллические вещества проводят электрический ток, причем проводимость осуществляется за счет переноса ионов. Электрическая проводимость расплавов является характерным свойством любых ионных структур.
Ионные решетки характерны для большинства неорганических соединений (соли, оксиды и другие классы соединений). Многие минералы также имеют ионное строение. Так, кристаллы, имеющие ионную решетку, как правило, хорошо растворимы в воде, а растворы их обладают высокой электрической проводимостью. В твердом виде ионные кристаллы не проводят электрический ток, так как в них электроны прочно удерживаются в атомных орбиталях отдельных ионов. В расплавленном состоянии кристаллические вещества проводят электрический ток, причем проводимость осуществляется за счет переноса ионов. Электрическая проводимость расплавов является характерным свойством любых ионных структур.