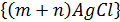|
|
Электролитпен коагуляциялау кинетикасы 23 главаДисперстік жүйелердің агрегаттық тұрақтылығын арттырудың ең тиімді тәсілдерінің бірі- құрылымды – механикалық фактор, оны алғаш рет П.А. Ребиндер жан–жақты етіп қарастырды. Бұл фактордың мәні дисперстік фаза бөлшектерінің бетінде тұтқырлығы жоғары сірне тәрізді қабаттың түзілуінде (3- суретті қара). Бұл қорғаушы қабат БАЗ, полимерлердің молекулаларымен жасалуы мүмкін. Құрылымды – механикалық қорғаушы қабатты жасауға қабілетті келешегі мол полимерлерге суда еритін синтетикалық, табиғи полиэлектролиттерді айтуға болады. Жабылу аймағы ДФ бөлшектері
Fтеб Fтеб
Қорғаушы қабаттар 3-сурет. Құрылымдық-механикалық қабаттың сұлбасы.
Оларға карбоксилметилцеллюлоза, белоктар, глюкозидтер және т.б. жатады. Құрылымды – механикалық стабилизаторлардың (тұрақтандырғыш-тардың) әсер ету тиімділігі қорғаушы қабаттардың тұтқырлығына, механикалық беріктігіне (мықтылыгына), қорғаушы қабаттың сыртқы жағының лиофильдігіне, сондай-ақ қорғаушы қабат пайда болатын ақауларды өздігінен “жөндеу” қабілетіне тәуелді болады. Қорғаушы қабаттың тұтқырлығы мен механикалық беріктігі артқан сайын агрегаттық тұрақтылық та артады. Дисперстік фазада 2 бөлшегі өзара жанасқанда, әсіресе тұтқыр қорғаушы қабаттары бірін – бір жапқанда олардың арасында Ла-Шателье принципі бойынша тебілу күштері ( Fтб) пайда болады, ол энергетикалық тосқауылдың артуына себебін тигізеді. Ендеше, дисперстік жүйенің агрегаттық тұрақтылығы да симбатты түрде өзгереді, яғни артады. 4. Тұрақтылықтың энтропиялық факторы. Коагуляция болғанда жүйедегі бөлшектер саны азаяды, ендеше, энтропия да ( Бұл фактордың 2 құрамдасы болады, олардың екеуі де бір бағытта “жұмыс істейді” де, потенциалдық тосқауылды (ΔU) артуын, ендеше агрегаттылық тұрақтылықтың артуын болдырады. 1. Дисперстік фаза бөлшектерінің бірігуінің нәтижесінде олардың жалпы саны азаяды.Гиббс энергиясының энтропиялық құрамдасының тұрғысынан дисперстік фаза бөлшектерінің бірігу үдерісі тиімсіз, өйткені ол жүйенің энтропиясын азайтады. Больцман өрнегін еске алайық S=klnW, мұндағы W - дисперстік жүйе жүзеге асатын тәсілдер саны. Дисперстік фаза бөлшектерінің санының N азаюы жүйедегі мүмкін болатын қайта қалыптасу санын азайтады, ендеше жүйенің жүзеге асатын тәсілдер санын (W) азайтады, ол Больцман теңдеуі бойынша коллоидтық жүйенің энтропиясын (S) азайтады. 2. Дисперстік фаза бөлшектерінің тұрақтандырғышы ретінде полимердің макромалекулаларын қолданады, бұл жағдайда 2 бөлшектің қорғаушы қабаттары өзара жабылған кезде жанасу аймағында (3 – суретті қара) макромалекулаларының конформациялық өзгеруі болады. Жанасу аймағы
Бөлшектердің қорғаушы қабаттарының жанасу аймағында макромалекулалардың тиімді концентрациясының артуы байқалады, соның салдарынан макромолекулалық шумақтардың тиімділік өлшемдері ( R2)0.5азаяды. Олардың азаюы W мен S–тің симбатты түрде өзгеруіне алып келеді (екеуі де азаяды). Ле-Шателье принципі бойынша дисперстік жүйелер осы жағымсыз үдеріске қорғаушы потенциалдық тосқауылды арттырып қарсы тұруға ұмтылады. Бұл жоғарыда айтылған коллоидтық жүйелерді тұрақтандырудың энтропиялық факторының 2 құрамдасының әсерінен болады. 5. Тұрақтылықтың гидродинамикалық факторы. Оны дисперстеуші ортаның тығыздығы мен динамикалық тұрақтылығының артуы болдырады. Кәдімгі реалды жағдайларда, әдетте, бір емес, бірнеше фактор әсер етеді. Әр фактордың өзіндік ерекшеліктері болады. Сол себепті тұрақтылықтың жалпы теориясын жасау да оңайға түспейді. Дегенмен тұрақтылық пен коагуляцияның сапалық және сандық теориялары бар. Енді солармен танысайық.
5 Коагуляция мен тұрақтылықтың сапалық теориялары Коагуляцияның механизмі туралы мәселе коллоидтық химияның негізгі мәселелерінің бірі. Ол мицеллалықтеориямен бірге басталып осы уақытқа дейін дамуда. Сонда да болса бұл мәселе толық шешілмеген нәрсе. Коагуляцияның жалпы теориясын жасауда Кройт пен Дерягиннің жұмыстарының маңызы зор. Коагуляция механизмін түсіндіретін теориялық көзқарастың үш бағытын айтқан жөн: химиялық , адсорбциялық , электростатикалық. 1. 1907 ж Дюкло каогуляцияның химиялық теориясын жасады. Ол 2. 1908ж зольдердің адсорбциялық мицеллалық теориясын қалаушылардың бірі Фрейндлих коагуляцияның адсорбциялық теориясын ұсынды. Ол коллоидтық бөлшектердің коагулят-иондарды жұтуы химиялық әрекеттесудің нәтижесінде емес, олардың адсорбциясының нәтижесінде болады деп есептеді. Коагуляция мен электролиттің концентрацияларының арасындағы байланысты Фрейндлих адсорбция изотермасы сияқты эмпирикалық теңдеумен көрсетті.
Біріншіден,коагуляция адсорбцияланған электролит пен бейтарапталған потенциал анықтағыш иондардың эквивалентті емес екені белгілі. Мысалы, адсорбция үшін сол эквивалентті мөлшерден де артық электролит керек.
Екіншіден,бұл теория бойынша әртүрлі иондардың изотермасы бірдей, ендеше олардың коагуляция табалдырығы бірдей болу керек. Ал бізге бірдей валентті иондардың коагуляция үшін лиотроптық қатардың болатыны белгілі. 3.1928ж. Мюллер сол кезде жаңа шыққан күшті электролиттердің Дебай мен Гюккель жасаған электростатикалық теориясын пайдалана отырып коагуляцияның электростатикалық теориясын жасады. Ол тұрақтылық потенциалы деп ξ потенциалын қарастырды. Бұнда ξ потенциалдың кемуі және зольдердің тұрақтылығының кемуі бөлшектердің потенциал анықтағыш иондарының бейтараптануының нәтижесінде кемуімен емес, диффузиялық қабаттың қысылуымен түсіндіріледі. Дебай мен Гюккель теориясындағы күрделі математикалық аппаратты қолдана отырып ол ξ потенциалдың кемуі мен электролиттің концентрациясы арасындағы байланысты көрсетті, онымен қатар Шульце-Гарди ережесін де түсіндірді. Алайда бұл теорияда коагуляция кезіндегі барлық құбылыстарды түсіндіре алмады және де лиофобтық зольдердің коагуляциясы адсорбцияның нәтижесінде болатынын теріске шығарды. 4. 30 - шы жылдары (1932 ж.) Рабинович коагуляцияның жаңа теориясын жасады, ол алғашқы адсорбциялық (онымен бірге химиялық теорияны да) және электростатикалық теорияны біріктіре қарастырды. Бұл теориялардың біріншісі иондар арасындағы электростатикалық күшті елемесе, екіншісі иондық алмасу адсорбциясын еске алған жоқ болатын. А.И.Рабинович пен В.А.Каргиннің зерттеулерінің нәтижесінде коагуляцияның өте күрделі процесс екені және оның кем дегенде 2 сатыдан тұратындығы көрсетілді: 1- саты - иондардың алмасу адсорбциясы, бұл өте тез және алмасатын иондардың эквиваленті мөлшерінде болатын саты. 2 - саты ол электролиттердің әсерінен болатын кәдімгі коагуляция, мұнда әрине эквиваленттік сақталмайды. Шульце-Гарди ережесін тек осы саты үшін ғана қолдануға болады. Әрине бұл айтылған теорияның бәрі коагуляцияны сапалық түрде ғана сипаттайды. Коагуляцияны сандық түрде сипаттайтын теорияны жасауда және коагуляция механизмін түсіндіруге Б.В.Дерягиннің жұмыстарының маңызы зор. Енді соған тоқталайық.
6.Лиофобтық кірнелердің тұрақтылығының теориясы – ДЛФО теориясы Тұрақтылықтың қазіргі теориясын ресейлік ғалымдар Б.В.Дерягин және Л.Д.Ландау, сәл кейінірек голландиялық ғалымдар Фервей мен Овербек жасаған. Сондықтан тұрақтылықтың қазіргі теориясын осы ғалымдардың фамилияларының бас әріптерімен атап ДЛФО теориясы деп атайды. Коллоидтық бөлшектер бір біріне өте жақындағанда олардың диффузиялық қабаттары бір бірін жауып, әрекеттеседі. Бұл әрекеттесу бөлшектерді бөліп тұратын дисперстеуші ортаның жұқа қабатында болады. Лиофобтық кірнелердің тұрақтылығы негізінен осы жұқа сұйық қабаттың ерекше қасиеттерімен анықталады. Дисперстеуші ортадағы екі коллоидтық бөлшек бір біріне жақындағанда алғашқы кезде оларды сұйықтықтың қалың қабаты бөліп тұрады; ол қабат біртіндеп жұқара береді де, нәтижесінде өте жұқа қабатқа айналады. Өте жұқа қабат түзілгеннен кейін оның жұқаруы әрі қарай жалғаса беруі мүмкін, ол бөлшектерді одан әрі қарай жақындатады. Сұйық қабаттың жұқаруы иә оның қалыңдығы өте аз болғанда, иә әрі қарай кішіреймейтін қандай да бір тепе-теңдік қалыңдықта аяқталады. Бірінші жағдайда бөлшектер бір-бірімен бірігеді, ал екінші жағдайда бірікпейді. Жұқа сұйық қабаттың қасиетері коагуляцияның болу-болмауын, яғни кірнелердің тұрақтылығын анықтайды. Зерттеулер бөлшектердің өзара жақындағанда жұқа қабаттың жұқаруы одан сұйықтықтың шығып кетуінен болады. Сұйық қабат айтарлықтай жұқа болғанда (оның қалыңдығы 100-200 нм-ден аз болғанда), ондағы сұйықтықтың қасиеттері қоршаған көллемдегі сұйықтық қасиеттерінен өте күшті өзгере бастайды. Осы кезде қабатта қосымша қысым пайда болады, оны Б.В.Дерягин «сыналық қысым» деп атады. Дерягиннің анықтамасы бойынша қабаттағы қысым төмендесе оң таңбалы болады, ол қабаттан сұйықтықтың шығып кетуіне кері әсер етеді, яғни коллоидтық бөлшектердің бірігуіне кедергі жасайды. Сол себептен «сыналық қысым» деп атаған, яғни бөлшектерді біріктірмей қозғалтады, сыналайды. Сыналық қысымның таңбасы теріс болуы мүмкін, яғни қабатта қысым көбейеді, ол қабаттан сұйықтықтың шығып кетуін жылдамдатады және бөлшектердің бірігуін де жылдамдатады. Осы жұқа қабатта сыналық қысымның пайда болуына негізінен екі фактор әсер етеді: 1) Қабаттағы электростатикалық әрекеттесу – ол энергиясы Uтб>0 тебілу күштері 2) Энергиясы Uтр˂0 ван-дер-ваальстік тартылу күштері Бөлшекаралық әрекеттесудің шешуші энергиясы U деп екі құрамдастың сомасы (қосындысы) ретінде анықталады: U = Uтб + (-Uтр) = Uтб – Uтр Екі |Uтб|>|Uтр| болса, онда тебілу күштері басым болғандықтан коагуляция болмайды, кірне агрегаттық тұрақты болады. Керісінше жағдайда тартылу күші басым болғандықтан бөлшектер бірігіп коагуляция болады. Осы күштерді сандық түрде түсіндіріп көрейік.
Тебілудің электростатикалық күштері Мицеллалар арасындағы электростатикалық тебілу қарсы иондардың диффузиялық қабаттары бір-бірін жапқанда пайда болады. Ол әрекеттесудің энергиясы былайша анықталады: Uтб = A*e-ϰh (16) мұндағы: h – бөлшектердің ара қашықтығы; ϰ=1/δ – ол диффузиялық қабат қалыңдығына δ кнрі шама; А - ол h-қа тәуелсіз, ҚЭҚ параметрлерімен анықталатын шама. Κ және A шамаларын ҚЭҚ теориясының негізінде есептеуге болады. Есептеулер тебілу энергиясының (Uтб) қарсы иондардың зарядтары мен концентрациялары артқанда және φ0-мен ξ-потенциалдарының абсолюттік шамалары төмендегенде азаятынын көрсетті. (16) теңдеуден Uтб бөлшектердің ара қашықтығы h артқан сайын экспоненциалды түрде өседі. (2-сурет)
Тартылудың ван-дер-ваальстік күштері Тартылу энергиясы, негізінен, молекулалар арасындағы дисперсиялық әрекеттесумен байланысты. Оны мына теңдеумен есептеуге болады: Uтр = -Ar / 48πh2 (17) мұндағы Ar – Гамакер коснтантасы, ол 10-12 эрг-ке тең. Ол кванттық-статикалық жолмен есептелген және оған коагуляциялық және адгезиялық әрекеттесулердің жеке константалары кіреді. (17)-теңдеуден тартылу энергиясы бөлшектердің арақашықтығы (h) артқан сайын қашықтық квадратына кері пропорционалды түрде өзгертетіні көрініп тұр. Сонымен, тартылу қашықтығына байланысты баяу төмендейді екен. Мысалы: h 100 есе артқанда тартылу энергиясы 104 есе азаяды, ал тебілу энергиясы 1043 есе азаяды. Арақашықтығы h бөлшектердің арасындағы шешуші әрекеттесу энергиясы мына теңдеумен анықталады: U(h) = A * e-ϰh – Ar/48πh2 (18) Тебілу энергиясы мен тартылу энергиясының h-қа байланысты өзгеру сипаты әртүрлі болғандықтан бөлшектер арасының қашықтығына байланысты шешуші потенциалдық энергияның өзгеруі күрделі сипатта болады. Осы тәуелділіктің U=f(h) жалпы түрі 2-суретте көрсетілген.
2-сурет. Екі коллоидтық бөлшектің әрекеттесуінің потенциалдық энергиясы Екінші суреттегі графиктің үш аймағына жеке-жеке тоқталайық: 1) ˂h˂h1, U(h)˂0 бұл кезде бөлшектің арасында тартылу күштері басым болады, жақын минимум (шұңқыр) байқалады. Uтб → тұрақты, Uтр → ∞ Бұл кезде коагуляция болады. 2) h1˂h˂h2, U(h)>0. Бұл кезде бөлшектер арасында тебілу күштері басым болады, яғни Uтб>|Uтр|. Бұл кезде бөлшектер бірікпейді. 3) h2˂h˂h3, U(h)˂0 – бұл кезде қашық минимум (шұңқыр) байқалады, алайда оның тереңдігі онша емес Үш жағдайда h=h1, h=h2, h=h3 U(h) = 0 болады, яғни осы арақашықтықтарда тебілу күштер мен тартылу күштері өзара тең. Сонымен, енді бөлшектер h1 қашықтыққа жақындаса, онда олар бір бірімен бірігеді екен, алайда ол үшін потенциалдық тосқауылды жеңу керек. Ол бөлшектердің кинетикалық энергиясы (КТ) айтарлықтай көп болуы керек. Екі бөлшектің әрекеттесуін қарастырайық. Бір бөлшекті қозғалмайды, ал екінші бөлшек оған қарай КТ энергиясымен жақындайды деп есептейік. Егер KT˂ΔUmin болса, бөлшектер hmin қашықтығында қалады және бір бірімен дисперстеуші орта қабаты арқылы байланысқан болады, яғни «жұп» түзеді, бірақ тікелей бірікпейді және өзінің седиментациялық тұрақтылығын жоғалтпайды. Бұндай жағдайларда қашық минимумдегі әрекеттесу деп атайды. Егер ΔUmin˂KT˂ΔUk болса, онда бөлшектер бір-бірімен соқтығысқанда бір-бірімен бірікпей, керісінше жан-жаққа ұшады. Жүйе агрегаттық тұрақты болады. Егер KT˂ΔUk болса, онда баяу коагуляция, ал егер KT>ΔUk болса, онда жылдам коагуляция болады. Әдетте зольді тұрақты (бөлмелік) температурада қарастыратындықтан бөлшектердің кинетикалық энергиясы тұрақты болады. Ендеше, коагуляция болу үшін потенциалдық тосқауылды азайту керек. Әдетте потенциалдық тосқауылды азайту үшін жүйеге электролит-коагулянт енгізеді. ДЛФО теориясы жылдам коагуляция табалдырығы Сжк есептеуге мүмкіндік береді: Cжк = B*E(KT)5/A2*e6z6 (19) мұндағы: A, B – есептеуге болатын тұрақты шамалар; E – ортаның диэлектрлік өтімділігі; z – ион-коагулянт заряды; e – элеткрон заряды. Бұл формуладан ДЛФО теориясы бойынша қорытылған коагуляция табалдырығының ион-коагулянт зарядының тәуелділігі Шульце-Гардидің эмпирикалық ережесіне сәйкес келетін болжауға болады: Сшк = B*
Электролиттік коагуляция түрлері Зольдерді электролиттермен коагуляциялағанда екі түрлі коагуляция болады: концентрациялық коагуляция және бейтараптану коагуляциясы. Концентрациялық коагуляуцияиндеференттік электрлиттің әсерінен болады; ол кезде қарсы иондардың диффузиялық қабат қысылу салдарынан ζ-поетнциалының абсолюттік мәні азаяды. Күміс нитратымен тұрақтанған хлорлы күміс кірнесіне калий нитратын қосқандағы концентрациялық коагуляцияны қарастырайық. Ол кірненің мицелласының формуласын былай жазуға болады:
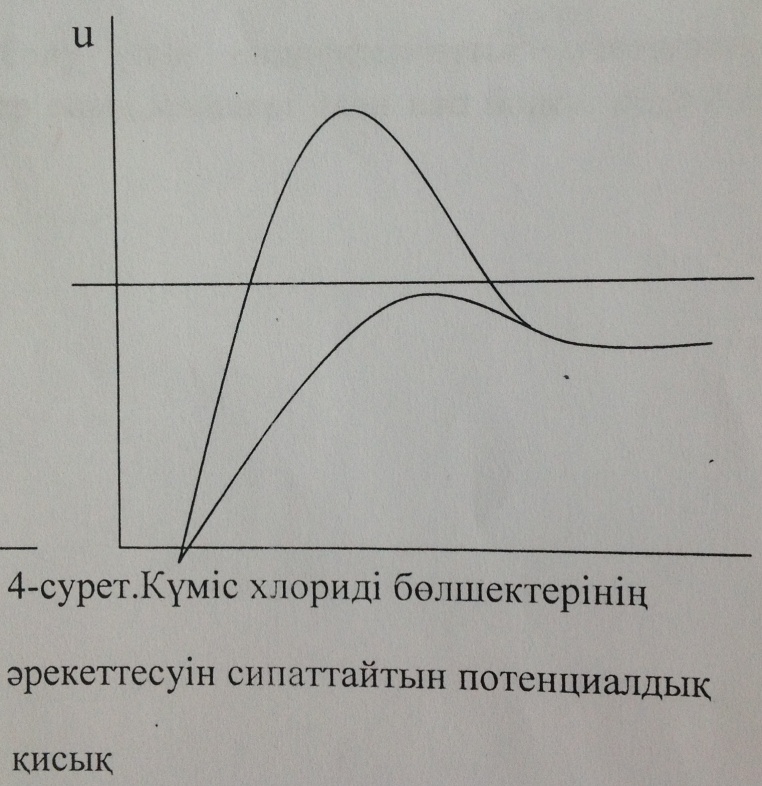
3- суретте күміс хлориді мицелласының ҚЭҚ-тың потенциал өзгерісінің графигі көрсетілген.
3- сурет. Күміс хлориді мицелласының 4-сурет. Күміс хлориді бөлшектерінің ҚЭҚ-тың потенциал өзгерісі әрекеттесуінің сипаттайтын потенциалдық қисық
Ондағы 1- қисық бастапқы мицеллаға, ал 2-қисық күміс нитратының коагуляция болдыратындай мөлшерде қосқаннан кейінгі жағдайға тән қисықтар. Күміс нитратын қосқанда қарсы иондардың диффузиялық қабаты қысылады да, мицелланың формуласы мынадай болады: 4-суретте осы кірнедегі бөлшектердің әрекеттесуін сипаттайтын потенциалдық қисықтар берілген. Бастапқы коллоидтық бөлшектің Бейтараптану коагуляциясы кірнеге индиференттік емес электролит қосқанда болады. Фаянс-Панет ережесі бойынша бұл кезде потенциал анықтағыш иондар қиын еритінқосылыстарға айналып, термодинамикалық потенциалдың ( Бастапқы кірне ретінде қарастырған
Жүйеде Бұл жолы коагуляция себебі потенциал анықтағыш иондардың бейтараптануы болғандықтан, мұндай коагуляцияны бейтараптану коагуляциясы деп атайды. Толық бейтараптану коагуляциясы болу үшін индифференттік емес электролит тек эквивалентті мөлшерде қосылуы керек. Егер оның мөлшері одан көп болса, онда “қайта зарядталу” құбылысы болады.
Коллоидтық жүйелердің тұрақтылығы мен коагуляциясының қазіргі теориясы (ДЛФО теориясы) Қазіргі кезде жалпыға бірдей қабылданған электролиттік коагуляцияның жалпы теориясы — ол статикалық физиканың жалпы принциптеріне, ерітінділер теориясына және молекулалық күштердің әсерінің теориясына негізделе отырып жасалған коагуляцияның физикалық теориясы. Бұл теория бөлшектердің арасындағы молекулалық тарту және электростатикалық тебу күштерінің баланстарын қарастыра отырып электролиттік коагуляцияны түсіндірді. |
|
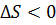 ) азаяды. Ал ол болса, термодинамикадан білетініміздей, жүйенің еркін энергиясының (
) азаяды. Ал ол болса, термодинамикадан білетініміздей, жүйенің еркін энергиясының (  ) азаюына әкеп соғады. Сондықтан жүйе өздігінен бөлшектерді бір-бірінен тебуге және бірқалыпты (хаосты түрде) жүйе көлемі бойынша таратуға ұмтылады. Энтропиялық фактор осыған негізделген. Алайда коллоидтық ерітіндідегі бөлшектер саны, массалық концентрациясы дәл осындай, бірақ шынайы ерітіндімен салыстырғанда әлдеқайда аз болады, сондықтан энтропиялық фактордың әсері онша көп болмайды. Бірақ, егер бөлшектер мейлінше ұзын тізбегі бар және сондықтан көп конформацияланатын заттармен (ҮМҚ) тұрақтандырылса, онда бөлшектер жақындағанда олардың қорғағыш қабаттары әрекеттеседі. Бұл әрекеттесу мүмкін болатын конформациялар санын азайтады, ендеше энтропияны азайтады. Сондықтан жүйе бөлшектері бір- бірінен тебілуіне ұмтылады.
) азаюына әкеп соғады. Сондықтан жүйе өздігінен бөлшектерді бір-бірінен тебуге және бірқалыпты (хаосты түрде) жүйе көлемі бойынша таратуға ұмтылады. Энтропиялық фактор осыған негізделген. Алайда коллоидтық ерітіндідегі бөлшектер саны, массалық концентрациясы дәл осындай, бірақ шынайы ерітіндімен салыстырғанда әлдеқайда аз болады, сондықтан энтропиялық фактордың әсері онша көп болмайды. Бірақ, егер бөлшектер мейлінше ұзын тізбегі бар және сондықтан көп конформацияланатын заттармен (ҮМҚ) тұрақтандырылса, онда бөлшектер жақындағанда олардың қорғағыш қабаттары әрекеттеседі. Бұл әрекеттесу мүмкін болатын конформациялар санын азайтады, ендеше энтропияны азайтады. Сондықтан жүйе бөлшектері бір- бірінен тебілуіне ұмтылады.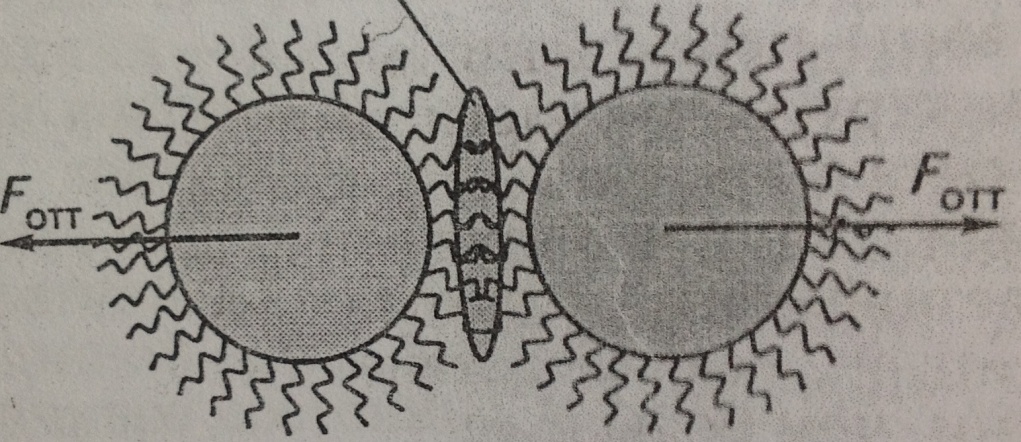
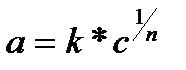 ; мұндағы a – коагулятпен байланысқан иондар саны, с- электролиттің тепе-теңдік концентрациясы, к мен n константалар. Химиялық теория түсіндіре алмаған Шульце-Гарди ережесін Фрейндлих адсорбциялық теория арқылы түсіндірді. Алайда сандық жағынан бұл теория өте дәл келмейді. Тағы да бұл теорияның мынадай кемшіліктері бар.
; мұндағы a – коагулятпен байланысқан иондар саны, с- электролиттің тепе-теңдік концентрациясы, к мен n константалар. Химиялық теория түсіндіре алмаған Шульце-Гарди ережесін Фрейндлих адсорбциялық теория арқылы түсіндірді. Алайда сандық жағынан бұл теория өте дәл келмейді. Тағы да бұл теорияның мынадай кемшіліктері бар. 1.11 – сурет.
1.11 – сурет.

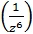
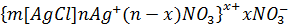

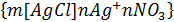
 -потенциалы оң болады, ол потенциалдық тосқауыл
-потенциалы оң болады, ол потенциалдық тосқауыл  (1- қисық) жасайды. Сондықтан коллоидтық бөлшектер соқтығысқанда бірін бірі тебеді де, коагуляция болмайды. Калий нитратын қосқаннан кейін
(1- қисық) жасайды. Сондықтан коллоидтық бөлшектер соқтығысқанда бірін бірі тебеді де, коагуляция болмайды. Калий нитратын қосқаннан кейін  (2- қисық). Сондықтан коллоидтық бөлшектердің жақындауына ешнәрсе кедергі жасамайды, олар соқтығысып бірігеді, яяғни коагуляция болады. Қарастырған жағдайда коагуляцияның себебі қарсы иондар концентрацияның артуы болғандықтан, оны концентрациялық коагуляция деп атайды.
(2- қисық). Сондықтан коллоидтық бөлшектердің жақындауына ешнәрсе кедергі жасамайды, олар соқтығысып бірігеді, яяғни коагуляция болады. Қарастырған жағдайда коагуляцияның себебі қарсы иондар концентрацияның артуы болғандықтан, оны концентрациялық коагуляция деп атайды.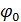 ) абсолюттік мәні азаяды, ендеше,
) абсолюттік мәні азаяды, ендеше,  кірнесін алсақ, онда потенциал анықтағыш иондарды
кірнесін алсақ, онда потенциал анықтағыш иондарды  бейтараптау үшін кірнеге, мысалы, калий хлоридін енгізу керек. Осы индифференттік емес электролиттің белгілі- бір мөлшерін қосқаннан кейінгі мицелланың формуласы былай болады:z
бейтараптау үшін кірнеге, мысалы, калий хлоридін енгізу керек. Осы индифференттік емес электролиттің белгілі- бір мөлшерін қосқаннан кейінгі мицелланың формуласы былай болады:z