|
|
Электролитпен коагуляциялау кинетикасы 16 глава
Мұндағы: Осы өрнектерді Липпман теңдеуіне қойсақ:
(2.6) және (2.8) теңдеулерді салыстырып, мына теңдеуді жазуға болады:
Мұндағы:
Алынған (2.9) – теңдеу электродтық потенциалдың Нернст теңдеуі деп аталады. Бұл жоғарыдағылардан Гиббс, Липпман, Нернст теңдеулерінің байланысын көруге болады. Потенциаланықтағыш ион көп адсорбцияланып беттік керілуді өзгертетінін, ал ол болса фазааралық шекарада потенциалды эквивалентті түрде арттыратынын байқаймыз.
4.2.1 Электркапиллярлық қисықтың теңдеуі және оны эксперимент түрінде зерттеу Егер ҚЭҚ-ты жазық конденсатор деп қарастырсақ, онда оның интегралдық сыйымдылығы тұрақты және мынаған тең болады:
(2.10)-теңдеудегі сыйымдылық зарядтың тығыздығы
Бұл теңдеуді
немесе
Есептеудің басы ретінде нольдік заряд нүктесіндегі потенциалды алсақ, яғни онда:
(2.11), (2.12) - теңдеулер электркапиллярлық қисық теңдеулері деп аталады. Бұл теңдеулерден ҚЭҚ-тың сыйымдылығы тұрақты болғанда беттік керілу парабола теңдеуіне сәйкес өзгереді екен. Параболаның шыңы максималдық беттік керілуге
4.5 – сурет. Теориялық электркапиллярлық қисық.
Параболаның төбесі нөльдік заряд нүктесіне сәйкес келеді. Бұл нүктеде Егер потенциаланықтағыш иондар Н+ және ОН- иондары болса,мысалы, элементтердің оксидтері, беттің зарядының болмауы рН-тың белгілі бір мәніне сәйкес келеді, ол изоэлектрлік нүкте деп аталады. Бұл нүктеде теріс және оң зарядтардың саны бірдей, беттің жалпы заряды нөльге тең болады. Электркапиллярлық қисықтың теңдеуі деп аталуы алғаш рет Липпман капиллярлық электрометр (4.6-сурет) деген құралдың көмегімен өзінің өрнектеген тәуелдіктерін эксперимент арқылы тексерді. Беттік керілудің қос электрлік қабатының потенциалына байланысты өзгеруін зерттегенде фазалардың бірі ретінде сынапты алу ыңғайлы. Өйткені оның беттік керілуін өлшеу оңай және сыртқы ток көзі арқылы фазааралық потенциалды өзгерту ыңғайлы. Оның үстіне сынап идеалды поляризацияланатын электрод, яғни тоқ жүргенде электродтың реакциясы болмайды. Сондықтан электродтың зарядының өзгеруі тек оның потенциалының өзгеруін болдырады. Капиллярлық электрометрдің жұмыс істеу принципі және оның құрылысы 4.6-суретте көрсетілген.
4.6 – сурет. Капиллярлық электрометрдің сұлбасы 1 – сынабы бар капиллярлық түтікше; 2 – сынабы бар ыдыс; 3 – резеңке шланг; 4 – электролиті бар стакан; 5 – каломельдік электроды бар ыдыс; 6 – реостат; 7 – тоқ көзі (аккумулятор)
Сынабы бар капилляр 1 ток көзінің 7 бір полюсімен қосылған каломельдік электрод арқылы байланысқан электролитке батырылған. Сынап электролит ертінідісімен жанасқанда (мыс, натрий сульфаты электр өткізгіштікті арттыру үшін қосылған) фазааралық потенциал пайда болады. Сыртқы ток көзінің көмегімен потенциалды өзгертеді, ал сынап ерітінді шекарасындағы беттік керілуді өзгертеді. Ыдысты 2 көтеріп, немесе төмендетіп сынаптың деңгейін капиллярдағы деңгеймен теңгереді де, сынаптың жаңа жоғары жағынан деңгейін белгілеп, сол h биіктіктегі беттік керілуін анықтайды. Осы сияқты электрлік потенциал бойынша беттік керілу өзгеруін тіркеп электркапиллярлық қисық алады.
4.7 – сурет. Сынаптың беттік керілуінің, зарядының және қос электрлік қабаттың сыйымдылығының потенциалға тәуелділігі (эксперименттік электркапиллярлық қисық).
4.7-суретте беттік керілудің Оң потенциалда (қисықтың сол бөлігі) ерітіндідегі қарсы иондар қабатын аниондар түзеді. Ал электродтың теріс потенциалында қарсы иондар қабатын катиондар түзеді. Әдетте, аниондар катиондарға қарағанда аздап гидратацияланады және электр өрісіне күштірек поляризацияланады. Сондықтан олар электрод бетіне жақынырақ болады, ҚЭҚ-тың қалыңдығы да катиондарға қарағанда, оларда азырақ болады. Қос электрлік қабаттың қалыңдығы
Мұндағы Оң потенциалды (қисықтың сол бөлігі) арттырғанда сынап ерітінді шекарасындағы беттік керілу теріс потенциалды арттырғанға қарағанда күрт төмендейді. Міне, сол себептен 4.7-суреттің оң жағы сол жағына қарағанда баяулау өзгереді. Потенциал артуына байланысты аниондардың поляризациясы артады, ал q азаяды, олар электркапиллярлық қисықтың ассиметриясына күштірек әсер етеді. Потенциал көбірек болғанда катиондар да поляризациялануы мүмкін. Нәтижесінде теориялық электркапиллярлық қисыққа сәйкес келетін
4.2.2 БАЗ-дың электркапиллярлық қисыққа әсері Ерітіндіде БАЗ болғанда электркапиллярлық қисықтың формасы айтарлықтай өзгеруі мүмкін, өйткені БАЗ электрлік потенциалға қоса беттік керілуді қосымша өзгертеді. БАЗ-дың электркапиллярлық қисыққа әсері оның табиғаты мен концентрациясына тәуелді болады. Фазааралық беттік адсорбция, сондай-ақ электрлік потенциалға да тәуелді болады. Ол Липпман теңдеуіне сәйкес беттік керілуді анықтайды. Егер бетті-активтік заттың ионогендік қасиеті онша болмаса, онда ол беттің әлсіз заряд толған маңында жақсы адсорбцияланады. Оның олай болатын себебі: тек осындай жағдайда ғана беттік қабаттың Гиббс энергиясының ең үлкен азаюы болады. Осы айтылғандарды эксперимент мәліметтері толық дәлелдейді (4.8 – сурет).
4.9-сурет Электркапиллярлық қисықтың максимумы БАЗ қатысуында төмендейді, айқынырақ болмайды, бірақ потенциал осьі бойынша ығыспайды. Бұл заңдылық иондық емес БАЗ адсорбциясы бойынша нөльдік заряд нүктесін табу әдісінің негізін құрайды. Беттік активтілігі әр түрлі иондары бар заттар нөльдік заряд нүктесін потенциал өсуі бойынша иә оң, иә сол жаққа ығыстырады. Мысалы, Сонымен, бетті- активтік аниондар бетке адсорбцияланып тек фазааралық керілуді төмендетіп ғана қоймай, нөльдік заряд нүктесінің потенциалының мәнін одан әрі терісірек етеді. Беттік активтік катиондар адсорбцияланғанда (Th+4, Аl+3 және т.б.) керісінше тәуелділікті байқауға болады, яғни беттік активтік катиондар нөльдік заряд нүктесінің электрлік потенциалының мәнін оңырақ жағына қарай ығыстырады. Жоғарыда қарастырылған электркинетикалық және электркапиллярлық құбылыстардан коллоидтық (дисперстік) бөлшектердің заряды болатынын байқауға болады. Ол зарядтар қайдан пайда болады? – деген сұрақ тууы мүмкін. Енді осы сұрақтың жауабына тоқталайық.
4.3 Қос электрлік қабаттың пайда болуы Алғашқы кезде коллоидтық бөлшектердегі зарядтардың пайда болуын жанасқан кезде фазалардың электрондарының бір-біріне өтуінен деп қарастырған. Кейінірек келе бұл пікірдің дұрыс емес екенін көптеген тәжірибиелердің мәліметтерімен дәлелденді. Қазіргі кезде лиокірнелердегі коллоидтық бөлшектерде болатын зарядтарды үш түрлі себеппен болатын қос электрлік қабаттың болуынан деп есептейді. Оның біріншісі, бөлшектің бетіне ерітіндіге иондардың таңдамалы адсорбциясы болады, ал екіншісі сол заттың беттік молекулаларының иондарға ыдырауынан болады,ал үшінші себебі иондар емес полярлы молекулалардың дисперсиялық ортадан бетке адсорбциялану нәтижесінде болады деп қарастырады.Зарядтардың пайда болуының осы себептеріне қысқаша тоқталайық. 4.3.1 Беттік молекулалардың иондарға ыдырау нәтижесінде зарядтардың пайда болуы Қос электрлік қабаттың иондарға ыдырау жолымен түзілуін судағы кремний қос тотығы кірнесінде қос электрлік қабаттың пайда болуы арқылы түсіндіруге болады. SiO2 бөлшектерінің бетіндегі молекулалар сумен әрекеттесудің нөтижесінде гидраттанып кремний қышқылын түзеді. Ол диссоциацияланып иондарға ыдырайды:
Осының нәтижесінде Әрине Н2SiO3 диссоциацияланғандағы беттегі молекулалардың бәрі бірдей иондарға ыдырамауы мүмкін, бұл айтылған құбылыстардың мәнін өзгертпейді. Осы қарастырылып отырылған жағдайда барлық комплексіміз электрбейтарапты болады. Сурет Дәл осы сияқты алтынның кірнесін Бредиг тәсілімен алғанда да, ондағы иондардың болуын былайша көрсетуге болады:
Мұнда да коллоидтық жүйедегі дисперстік фазаның бөлшектері теріс зарядталып, Н+ ионы ерітіндіде болады. Осыларға ұқсас шынының беті суда калий иә натрий силикаты диссоциацияланатындықтан теріс зарядталған болады. Белоктардың макромолекулалары суда диссоциацияланатындықтан (карбоксил және амин топшаларының иондарына) ерітінді де зарядталған болады. Осы мысалдардың бәрі беттік молекулалардың диссоциациялантындығынан қос электрлік қабаттың пайда болатынына мысалдар. Шындығында да электркинетикалық құбылыстарды диэлектрлік тұрақтылығы аз болатын еріткіштерде байқай алмаймыз. Өйткені ондай еріткіштерде электролиттің айтарлықтай диссоциациясы болмайды. Осындай еріткіштерге мысалға: хлороформ, күкіртті көміртек, т.б. органикалық сұйықтар жатады. Ал полярлығы бар нитробензол, спирттер, ацетон сияқты сұйықтықтарда, әсіресе суда электркинетикалық құбылыстарды байқауға болады. Бұның бәрі қос электрлік қабаттың пайда болуының жоғарыда айтылған себептермен болатындығын дұрыстығын көрсетеді.
4.3.2 Зарядтардың таңдамалы адсорбция нәтижесінде пайда болуы Электролиттердің қатты дене бетінде ерітіндіден адсорбциясын қарастырған кезде иондардың таңдамалы адсорбциясының болатынын айтқан болатынбыз. Ендеше иондардың адсорбциясының нәтижесінде бөлшектер (дисперстік фаза) зарядталады. АgJ кристалының ертіндідегі болатын қос электрлік қабатты сұлбалық түрде былай көрсетуге болады. Бұндағы бетке адсорбцияланатын ионды, яғни кристалдық торға енетін J ионын – потенциал анықтағыш ион деп атайды. Ол бөлшекті теріс зарядтайды. Ал К + ионы (оны қарсы ион деп атайды) ертіндіде фаза арасына жақын орналасқан болады. Осы 4.11-суретте көрсетілген комплексті мицелла деп атайды. Ол электрбейтарапты болады. Бұл айтылған мысал егер бетіміз иондық құрылысты болғанда ғана болады. Онда өзімізге белгілі Панет-Фаянс ережесі бойынша адсобцияланатын ион- беттегі ионмен ерімейтін, иә өте қиын қосылыс түзетін ион болады. Сурет
Адсорбцияланатын ионның кристалдық торға енуі шарт емес. Мысалы, әлсіз сілті ертіндісіндегі графит бөлшектерінің қос электрлік қабаты гидроксиль иондарын адсорбциялаудың нәтижесінде болады. Қарастырылып отырған жағдайда ОН- ионының адсорбциялық қабілеті Nа+ ионының адсорбциялық қабілеттілігінен жоғары болуымен түсіндіріледі. 4.3.3 Зарядтардың иондық емес,полярлы молекулалардың дисперсиялық ортадан бетке адсорбциялануынан пайда болуы. Фазалар арасында болатын қос электрлік қабаттың пайда болу себептерін айттық. Енді осы қабаттың құрылысына тоқталайық. 4.3.3Қос электрлік қабат ионогендік емес, полярлы молекулалардың дисперсиялық ортадан адсорбциялануынан да пайда болады. Мысалы, метил табақшасына полиэтиленгликоль (ПЭГ) - CH2 – CH2O- судағы ерітіндісіне батырғанда ПЭГ малекулалары табақша бетіне адсорбцияланып, бетте белгілі бір ретпен орналасуынан фазааралық бөліну бетінде ҚЭҚ пайда болады. Бұл жағдайды жалпы екі фазаның жанасу жағдайларында дисперстік фаза беттік зарядының таңбасы Кен ережесі бойынша анықталады. Ол ережеге сәйкес: Жансушы екі фазаның қайсысының диэлектрлік өтімділігі жоғары болса, сол фаза оң зарядталады. Мысалы, сулы дисперсияларда көп жағдайда судың оң зарядталуын осы ережемен түсіндіруге болады. 4.4 Қос электрлік қабаттың қүрылысы Бұл тақырыпты баяндауды жеңілдету үшін жазық электрлік қабатты қарастырамыз. Ал шын мәнінде коллоидтық ертінділерде және уақ тесікті денелерде бұндай жазық қабаттар іс жүзінде кездеспейді. Егер қос электрлік қабаттың қалыңдығы беттің қисықтылығының радиусынан кіші болса, онда электрлік қабатты жазық деп қарастыруға болады. Бұдан басқа қос электрлік қабатты қарастырғанда тағы басқа жалпы жағдайларды еске алу керек. Ол жағдайларды қос электрлік қабаттың теориясын жасағанда теория авторлары еске ала отырып жасаған қос электрлік қабат дисперстік фазамен салыстырмалы түрде мықты байланысқан иондардан (потенциал анықтағыш иондардан) және оған эквивалентті мөлшердегі сұйық дисперсиялық ортада болатын заряды қарама-қарсы иондардан (қарсы иондардан) тұрады. Беттегі заряд бүкіл бетке бірқалыпты тараған беттік заряд деп қарастырылады. Қарсы иондар мен қос электрлік қабатқа кірмейтін қарсы иондардың зарядымен зарядтас, ертіндіде болатын бос иондардың арасында динамикалық тепе-теңдік болады. Дисперсиялық ортаны қос электрлік қабатқа әсері тек диэлектрлік тұрақтылығымен болатын шексіз фаза деп қарастыруға болады. Міне осы жоғарыда айтылған жағдайларды еске алатын болсақ онда қос электрлік қабаттың құрылысының теорияларының айырмашылығы, сол қарсы иондардың қабаттарының құрылысын әртүрлі түсіндірумен шектеледі. Енді осы қос электрлік қабаттың құрылысының теорияларына тоқталайық.
Гельмгольц-Перрен теориясы Бұл теория бойынша қос қабат бір жағы қатты дене бетінде екінші жағы қарама-қарсы зарядталған сұйықтыққа толатын жазық конденсатор есебіне қарастырылады. Әрине, ол екі жақтың арасын өте жақын деп есептейді. Бұндай қос қабаттың потенциалы жазық конденсатордың потенциалына тең, осы екі жақтың арасында өте күрт өзгеретін (түзу бойынша 4.12-суретті қара) болады да, ал беттік зарядтың мәні (q) физикадан белгілі мына формуламен анықталады:
Мұндағы: 4.12-суреттегі штрихталған бөлік дисперстік фазаны, ал штрихталмаған бөлік – дисперсиялық ортаны көрсетеді. Қос электрлік қабатты түзетін потенциал анықтағыш ион мен қарсы ион (+) және (-)пен белгіленген. Бұл суретте қос электрлік қабатта ғана емес оған қоса потенциалдың жалпы мәні, қатты фаза мен ерітінді арасындағы потенциалдың мәніне тең. Сурет
4.12 - суреттегі қос электрлік қабаттың құрылысының сұлбасы электркинетикалық құбылыстардың көп ерекшеліктерін түсіндіре алмайды. Сол себепті қазіргі кезде бұл сұлба коллоидтық химия үшін тарихи жағынан ғана қызықты. Осы сұлбаның негізгі кемшіліктерін айта кеткен жөн. Гельмгольц-Перрен жасаған теория бойынша қос электрлік қабаттың қалыңдығы өте аз, молекуланың шамасындай ғана. Ал гидродинамикалық зерттеулердің нәтижесінде қос электрлік қабаттың қалыңдығы одан да көп болатын белгілі болды. Егер Гельмгольц-Перрен теориясы дұрыс болса, онда электркинетикалық құбылыстар болмау керек еді, ал олардың болатыны бізге мәлім. Егер, бұрындағыдай сырғу жазықтығы қос электрлік қабаттағы екі жақтың арасында болады деп есептесек те Гельмгольц - Перрен теориясының дұрыс емес екенін көруге болады. Шындығында да егер электросмос, электрфорез құбылыстарындағы электркинетикалық потенциалдың мәнін алып қарастырсақ, егер жоғарғы теория дұрыс болатын болса электркинетикалық потенциалдың мәні, потенциал анықтағыш ион мен жалпы қарсы ионның арасындағы потенциалдар айырмасына тең болуы керек. Ал көптеген тәжірибелер электркинетикалық потенциалдың жалпы потенциалдан кем екенін және оның көптеген факторларға байланысты екенін көрсетті. Мысалы, жалпы потенциал индифферентік электролитке тәуелсіз болса (әрине олардың иондарының кристалдық торға ену қабілеті болмаған жағдайда), электркинетикалық потенциал олардың әсерінен күшті өзгереді екен. |
|
 -фарадей саны,
-фарадей саны,  -катиондардың заряды.
-катиондардың заряды.

 (2.8)
(2.8) (2.9)
(2.9) -ионның беттегі және ертіндідегі активтіліктері.
-ионның беттегі және ертіндідегі активтіліктері.
 (2.10)
(2.10) алынатындықтан беттің сыйымдылығы потенциалға тәуелсіз деп қабылдағандықтан,
алынатындықтан беттің сыйымдылығы потенциалға тәуелсіз деп қабылдағандықтан, 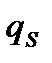 -тің мәнін Липпман теңдеуіне қойып, мынандай өрнектеуді аламыз:
-тің мәнін Липпман теңдеуіне қойып, мынандай өрнектеуді аламыз: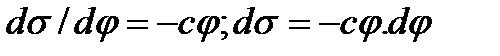
 -дан
-дан  -нің ең үлкен мәні және
-нің ең үлкен мәні және  -ге дейін (
-ге дейін (  нольдік заряд нүктесіндегі заряд)интегралдап, мынаны аламыз:
нольдік заряд нүктесіндегі заряд)интегралдап, мынаны аламыз: (2.11)
(2.11)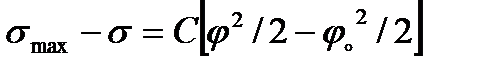
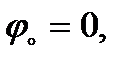
 (2.12)
(2.12) сәйкес келеді. Парабола симметриялы болады, өйткені аниондар мен катиондардың бетке ынтықтылығы бірдей деп қарастырылған, оң немесе теріс потенциалдың азаюы беттік керілудің артуына әкеп соғады. Реалды жүйелерді электркапиллярлық қисық симметриялы болмайды, өйткені ҚЭҚ-тың сыйымдылығы потенциалдың өзгеруіне байланысты аздап өзгереді.
сәйкес келеді. Парабола симметриялы болады, өйткені аниондар мен катиондардың бетке ынтықтылығы бірдей деп қарастырылған, оң немесе теріс потенциалдың азаюы беттік керілудің артуына әкеп соғады. Реалды жүйелерді электркапиллярлық қисық симметриялы болмайды, өйткені ҚЭҚ-тың сыйымдылығы потенциалдың өзгеруіне байланысты аздап өзгереді. нөльге тең болғандықтан беттік керілу потенциалға тәуелсіз болады, яғни бұл нүктеде беттік қабаттың заряды көп, ендеше қос электрлік қабат болмайды. Мысалы: химиялық потенциалы сол ерітіндіге матырылған металл табақшасының химиялық потенциалына тең ерітінді даярлауға болады. Мұндай жағдайда иондардың қайта таралуы болмайды және қос электрлік қабат түзілмейді. Бұл ерітіндіні нөльдік ерітінді дейді.
нөльге тең болғандықтан беттік керілу потенциалға тәуелсіз болады, яғни бұл нүктеде беттік қабаттың заряды көп, ендеше қос электрлік қабат болмайды. Мысалы: химиялық потенциалы сол ерітіндіге матырылған металл табақшасының химиялық потенциалына тең ерітінді даярлауға болады. Мұндай жағдайда иондардың қайта таралуы болмайды және қос электрлік қабат түзілмейді. Бұл ерітіндіні нөльдік ерітінді дейді. (эксперименттік), зарядтың және ҚЭҚ-тың сыйымдылығының (теориялық есептелген электрлік потенциалға тәуелділіктері көрсетілген).
(эксперименттік), зарядтың және ҚЭҚ-тың сыйымдылығының (теориялық есептелген электрлік потенциалға тәуелділіктері көрсетілген). 
 потенциалға (3) тәуелділігі анықталды. Эксперименттік тәуелділікті екінші дифференциалдау қос электрлік қабаттың сыйымдылығының потенциалға тәуелділігін алуға мүмкіндік береді. Эксперимент арқылы алынған электркапиллярлық қисық теориялық электркапиллярлық қисықты қайталайды. Сонымен Липпман теңдеуінің дұрыстығы расталды. Алайда ҚЭҚ сыйымдылығының потенциалға байланысты тәуелділігі реалдық жүйеде параболаның симметриялылығын бұзады екен. Оған негізгі әсер ететін – ҚЭҚ түзетін иондардың табиғаты.
потенциалға (3) тәуелділігі анықталды. Эксперименттік тәуелділікті екінші дифференциалдау қос электрлік қабаттың сыйымдылығының потенциалға тәуелділігін алуға мүмкіндік береді. Эксперимент арқылы алынған электркапиллярлық қисық теориялық электркапиллярлық қисықты қайталайды. Сонымен Липпман теңдеуінің дұрыстығы расталды. Алайда ҚЭҚ сыйымдылығының потенциалға байланысты тәуелділігі реалдық жүйеде параболаның симметриялылығын бұзады екен. Оған негізгі әсер ететін – ҚЭҚ түзетін иондардың табиғаты. аз болғаннан оның сыйымдылығы көп болатындығы белгілі.
аз болғаннан оның сыйымдылығы көп болатындығы белгілі. (2.13)
(2.13) -абсолюттік диэлектрлік тұрақтылық (өтімділік);
-абсолюттік диэлектрлік тұрақтылық (өтімділік); 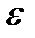 -салыстырмалы диэлектрлік тұрақтылық.;
-салыстырмалы диэлектрлік тұрақтылық.;  -
-  тең электрлік тұрақтылық.
тең электрлік тұрақтылық. -дің
-дің 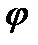 -ге сызықты тәуелділігі реалды жүйесінде нөльдік заряд нүктесіне жақын аймақта байқалады да, ал одан қашығырақ аймақта ол тәуелділік бұзылады.
-ге сызықты тәуелділігі реалды жүйесінде нөльдік заряд нүктесіне жақын аймақта байқалады да, ал одан қашығырақ аймақта ол тәуелділік бұзылады. ерітіндісі, 2-
ерітіндісі, 2-  ерітіндісіне пропион қышқылы қосылған,
3-
ерітіндісіне пропион қышқылы қосылған,
3-  ерітіндісі май қышқылымен қаныққан
ерітіндісі май қышқылымен қаныққан
 аниондардың адсорбциялануынан электркапиллярлық қисықтың ығысуы
аниондардың адсорбциялануынан электркапиллярлық қисықтың ығысуы иондары су–сынап бетінде беттік активтік емес (олар күшті гидратталған және сынапқа ерекше ынтықтылықтары жоқ), сондықтан олардың нөльдік заряд нүктесіне әсері әлсіз болады. Ал
иондары су–сынап бетінде беттік активтік емес (олар күшті гидратталған және сынапқа ерекше ынтықтылықтары жоқ), сондықтан олардың нөльдік заряд нүктесіне әсері әлсіз болады. Ал  ,
,  иондары берілген жүйе үшін бетті-активтік болады және олардың активтілігі осы қатар бойынша өседі. 4.9-суреттен аниондардың сынап электродының нөльдік заряд нүктесін электрлік потенциалдың теріс мәндері оң жағына қарай ығысатынын көреміз. Оның механизмін былайша түсіндіруге болады. Электрод бетінде теріс иондардың жиналуы электродтың адсорбцияланған иондарға қарағанда оң зарядтылығын арттырады. Аниондардың адсорбциясы күшейген сайын бұл эффект те күшейеді. Ендеше адсорбцияны тоқтату үшін, электрлік потенциалды тексеру үшін нөльдік заряд нүктесін алу үшін де көбірек теріс потенциал қажет болады.
иондары берілген жүйе үшін бетті-активтік болады және олардың активтілігі осы қатар бойынша өседі. 4.9-суреттен аниондардың сынап электродының нөльдік заряд нүктесін электрлік потенциалдың теріс мәндері оң жағына қарай ығысатынын көреміз. Оның механизмін былайша түсіндіруге болады. Электрод бетінде теріс иондардың жиналуы электродтың адсорбцияланған иондарға қарағанда оң зарядтылығын арттырады. Аниондардың адсорбциясы күшейген сайын бұл эффект те күшейеді. Ендеше адсорбцияны тоқтату үшін, электрлік потенциалды тексеру үшін нөльдік заряд нүктесін алу үшін де көбірек теріс потенциал қажет болады.
 иондары бөлшектің бетінде қалатындықтан бөлшек теріс зарядталады да, ал сутек ионы ертіндіге өтеді. Оның сұлбасын былай көрсетуге болады (4.10-суретте).
иондары бөлшектің бетінде қалатындықтан бөлшек теріс зарядталады да, ал сутек ионы ертіндіге өтеді. Оның сұлбасын былай көрсетуге болады (4.10-суретте).
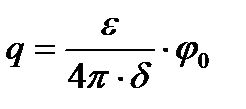
 – ортаның диэлектрлік тұрақтылығы;
– ортаның диэлектрлік тұрақтылығы;  – дисперстік фаза мен дисперсиялық ортаның потенциалдарының айырмасы;
– дисперстік фаза мен дисперсиялық ортаның потенциалдарының айырмасы;  – конденсатордың екі жағының ара қашықтығы.
– конденсатордың екі жағының ара қашықтығы.