|
|
Электролитпен коагуляциялау кинетикасы 1 главаКоагуляцияның сипаттамасы ретінде Зигмонди Коагуляция жылдамдығын пайдалануды ұсынған болатын. Коагуляция жылдамдығы
Теңдіктен кейінгі “ Коагуляция дәрежесі деп бірлік уақытта бөлшектердің соқтығысуының жалпы санын z бірлік уақыттағы тиімді соқтығысулар санына Zm қатынасын айтады. Егер Егер Егер Бөлшектер соқтығысқанда серпімді шарлар сияқты жан-жаққа шашырап кетпей, потенциалдық тосқауылдан асу керек. Ендеше, коллоидтық бөлшектердің кинетикалық энергиясы осы асудан асатындай болғанда ғана коагуляция болады. Коагуляция дәрежесін арттыру үшін потенциалдық асуды төмендету керек. Оған кірнеге электролит- коагулянт қосу арқылы қол жеткізуге болады. Коагуляция жылдамдығының электролит концентрациясына тәуелдігі 1.1- суретте көрсетілген.
1.2- сурет. Коагуляция жылдамдығының электролит концентрациясына тәуелділігі. Суреттегі үш аймақты жеке қарастыруға болады: 4. 5.
6.
Жылдам коагуляция Жылдам коагуляцияның кинетикалық теориясын М.Смолуховский 1916 жылы келесі тұжырымдамаға сүйене отырып жасады: 5. Қарастыратын жүйені монмдисперстік етіп алды, яғни бөлшектердің радиустары r бірдей болады. 6. Бөлшектердің соқтығысуының барлығын тиімді (пәрменді) деп қарастырады, яғни 7. Тек біріншілікті бөлшектердің соқтығысулары ғана қарастырылады. 8. Коагуляция кинетикасын бимолекулалық реакциясының кинетикасына ұқсас деп қарастырады:
Бұл теңдеуді интегралдап, айнымалы шамаларға бөлсек:
Мұндағы: Жылдам коагуляцияны сипаттау үшін коагуляция периоды (жартылай коагуляция периоды)
Жылдам коагуляция теориясына сәйкес коагуляция константасы диффузия коэффицентінетәуелді болады және оны мына теңдеумен есептеуге болады: K=16*r* Бұл теңдеуге диффузия коэффицентінің мәнін қоятын болсақ, мынадай теңдеу аламыз: K= Сонымен, ортаның тұтқырлығы және температурасын біле отырып, жылдам коагуляция жылдамдығының константасын есептеуге болады екен. Смолуховский теориясы эксперимент арқылы бірнеше рет тексеріп, оның дұрыстығы дәлелденді. Баяу коагуляция Баяу коагуляция энергетикалық тосқауыл болғандықтан, соқтығысулардың толық тиімді (пәрменді) болмайтындығымен байланысты. Смолуховский теориясының формуласына коагуляция дәрежесі 2 шамасын енгізу теория мен тәжірибенің бір-біріне сәйкес келмейтіндігін көрсетті. Сондықтан баяу коагуляцияның жетілген теориясын Н.Фукс жасады. Ол коагуляцияның кинетикалық теңдеуіне коагуляциялық энергия тосқауылын Р- стерикалық фактор, К- Больцман тұрақтысы Сонымен баяу коагуляцияның жылдамдық константасын есептеу үшін коагуляцияның потенциалдық тосқауылын білу керек екен. Оның шамасы ең алдымен 2.Дисперстік жүйелердің тұрақтылығының түрлері Дисперстік дүйелердің тұрақтылық мәселесі коллоидтық химияның маңызды мәселелерінің бірі. 1917 жылы Песков дисперстік жүйелердің тұрақтылығын қарастырғанда 2 түрлі тұрақтылыққа мән беру керек екенін айтты. Олар: седиментациялық немесе кинетикалық тұрақтылық және агрегаттық тұрақтылық. Тұрақтылықтың бұл 2 түрі механизмдері бойынша бір бірінен өзгеше болады. Сондықтан оларды жеке жеке қарастырайық.
Дисперстік жүйелердің седиментациялық тұрақтылығы Седиментациялық тұрақтылық деп дисперстік жүйелердің уақыт бойынша жүйенің көлемінде бөлшектердің таралуын өзгеріссіз сақтап қалу, яғни жүйенің ауырлық күшке қарсы тұру қабілетін айтады. Архимед заңы бойынша массаның орнына тиімділік массасын қоямыз, сонда бөлшек шөгуіне әсер ететін иауырлық күші мынадай болады: Fсед = m1g = V(ρ-ρ0)g (1.2) Тиімділік массасы m1 = V(ρ-ρ0) (1.3) болғандықтан бөлшектің иә шөгуі мүмкін ( егер Бөлшектер шөккенде дисперстеуші ортаның үйкеліс күші (Ғүй.) оларға қарсы әсер етеді: Ғүй.= В*Uсед. (1.4) Мұндағы : Uсед.- бөлшектің шөгу жылдамдығы ( седиментациялық жылдамдық); В- үйкеліс коэффициенті. Сонымен, седиментациялық күштің әсерінен бөлшек бірқалыпты үдей қозғалады да, оны азайтатын үйкеліс күші де оған сәйкес артады. Нәтижесінде, седиментацияның стационарлық режимі орнығып, ол кезде Ғсед.=Ғүй., бөлшек тұрақты жылдамдықпен шөгеді. Сонымен, V(ρ-ρ0)g= В*Uсед.. Бұдан седиментациялық жылдамдықты табатын болсақ: Uсед.= Седиментация үдерісін сипаттау үшін әдетте седиментация жылдамдығы Uсед. емес, седиментацияның меншікті ағынын ісед. пайдаланылады. Седиментацияның меншікті ағыны деп бірлік уақытта седиментация бағытын қиятын бірлік аудан қимасынан шөккен бөлшектер санын айтады. Оның өлшем бірлігі: [ісед.]= бөлшек/см2*с; Ендеше: ісед.= Uсед.* ісед.= Сонымен, седиментацияның меншікті ағыны V, Бұдан шар тәрізді бөлшектер үшін седиментациялық меншікті ағын радиустың квадратына тура, ал ортаның тығыздығына кері пропорционал екенін байқаймыз. Алайда, седиментация үдерісін қарастырғанда біз осы уақытқа дейін броундық қозғалысты еске алған жоқпыз. Микроскопиялық және коллоидтық өлшемдегі бөлшщектер броундық қозғалыста болатыны белгілі. Броундық қозғалыстың салдарынан диффузия болады, ол бөлшектердің концентрациясын төменгі қабаттарда артуына әкеп соғады. Сонымен, екі қарама- қарсы ағын байқалады: седиментация ағыны ісед. және диффузия ағыны ідиф.. Диффузия ағынын былай көрсетуге болады:
Бұл ағындардың бәсекелестігінің нәтижесі қалай болады? 3 түрлі жағдайда қарастыруға болады: 4) Бұл теңсіздік орындалу үшін Т және 5) Бұл жағдай Т және 6) Бұл жағдайда жүйеде седиментациялық- диффузиялық тепе-теңдік орын алады. Бұл теңдеуді интегралдап, айнымалы шамаларға бөліп, мыналарды аламыз:
Мұндағы:
Соңғы теңдеулерді Лаплас- Перреннің гипсометрлік заңы деп атайды. Бұл жағдайда жүйе седиментациялық тұрақты, бірақондағы бөлшектер бірқалыпты емес тепе- теңдік таралады. Бұл таралу Мысал ретінде дисперстік фазасы бөлшектері шар тәрізді болатын кремний диоксиді SiO2, ал дисперстеуші ортаның тығыздығы
1 кесте SiO2 –нің седиментациялық жылдамдығын бөлшектердің өлшеміне тәуелділігі
Кестеден лиофобтық кірнелерде седиментация өте баяу жүретінін байқауға болады. Сонымен, дисперстік жүйелерде седиментация тұрақтылық негізінен дисперстік фаза бөлшектерінің өлшемімен анықталады: 4. Лиофобтық кірнелер (10-7-10-5 см)-седиментациялық тұрақты жүйелер; оларға бөлшектерді жүйенің бүкіл көлемі бойынша бірқалыпты таралуды қамтамасыз ететін диффузия тән болады. 5. Микрогетерогендік жүйелерде (10-5-10-3 см) седиментациялық- диффузиялық тепе-теңдік орнығады; оларға бөлшектердің жүйенің бүкіл көлемі бойынша гипсометрлік таралуы тән болады. 6. Макрогетерогендік (дөрекі дисперстік) жүйелер (r
Коллоидтық ерітінділердің агрегаттық тұрақтылығы. Коагуляция Агрегаттық тұрақтылықдеп- дисперстік жүйелердің уақыт бойынша дисперстік дәрежелерін, яғни бөлшектердің өлшемін өзгертпей сақтап қалу қабілеттілігін айтады. Коагуляцияның екі сатысы болады:
3. Коагуляция және электролиттік коагуляцияның ережелері мен ерекшеліктері. Коагуляция деп коллоидтык бөлшектердің әртүрлі факторлардың әсерінен бірігіп іріленуін айтады. Коагуляцияны екі сатыдан тұратын процесс ретінде қарастыруға болады: 1. Жасырын коагуляция, оны көзбен көре алмаймыз, тек ультрамикроскоппен байқауға болады. 2. Айқын коагуляция, ол кезде оны қарапайым көзбен көруге болады. Лиофобтық кірнелерде жасырын коагуляция өте аз жүреді, ол өте жылдам айқын коагуляцияға ауысады. Ал ҮМЗ ерітінділерінде жасырын коагуляция өте ұзақ жүреді, тек коагуляция процессі аяқталарда ғана тоңазытпа (сірне), (кілегей массаның) пайда болғанын байқауға болады. Коагуляцияға әсер ететін факторлар: температура, механикалык әсерлер, ультрацентрафугалау, жоғарғы тиімділікті тербелістер, сәуле, электр өрісі, жүйеге басқа заттың енуі (әсіресе электролиттің) және т.б.. Олардың ең маңыздысы және көбірек зерттелген фактор-электролит. Енді электролит әсерінен болатын коагуляцияға тоқталайық. Электролиттік коагуляция.Кірнелердің тұрақтылығының электролит әсерінен өзгеруі коллоидтық жүйелерді алғашқы зерттеушілердің (Ф.Сельми, Т.Грем, М.Фарадей, Г.И.Борщев) жұмыстарынан-ақ белгілі болатын. Кейін келе Г.Шульце, У.Гарди, Г.Пиктон, О.Мендер, Г.Френдлих, В.Паули, Н.Песков, А.В.Думанский т.б зерттеушілердің жүмыстарының нәтижесінде көптеген мәліметтер жиналып және теориялық негізгі қорытындылар да жасалды. Электролиттік коагуляция теориясының дамуына В.Б.Дерягин, Г.А.Ребиндер және оның мектебі, Ю.М.Глазман т.б үлкен үлес қосты. Электролиттік коагуляцияның ережелері деп аталатын, тәжірибе жүзінде көрсетілген олардың негізгі заңдылықтарын қарастырайық. 1. Коагуляция табалдырығы. Коагуляцияны кез келген электролит тудыра алады, тек оның айқын жылдамдықта жүруі электролиттің белгілі бір концентрациясында болады. Электролиттің айқын коагуляцияны тудыратын ең аз концентрациясын "коагуляция табалдырығы" деп атайды. Оны көбінде 1 литр кірнедегі милимоль, иә милиграмм. экв.көрсетеді (
Электролиттің коагуляция тудыратын иондарды, әрқашанда таңбасы жағынан коллоидтық бөлшектердің таңбасына қарама қарсы болады, яғни оң зарядты коллоидтық бөлшектерді теріс зарядты иондар, ал теріс зарядты коллоидтық бөлшектерді оң зарядты иондар коагуляциялайды. Мысалы, Ғе(ОН)3 золі үшін аниондар, ал МпО2 үшін катиондар.
З. Валенттілік ережесі (Шульце-Гардидің І ережесі ). Электролиттің коагуляциялық қабілеттілігі коагулятордың, яғни иондардың валенттілігі артқан сайын күшейеді. Бүл заңдылықты Шульце-Гарди ережесі деп те атайды. Оны алғаш Шульце (1882ж), кейін Гарди (1910ж) күкіртті қалайыны зерттей отырып көрсеткен болатын. Мысалы, Sn2S3 үшін катиондардың (К+,Ва++, А1+++) коагуляция табалдырығы мынандай қатынаста болады: |
|
 деп- бірлік уақытта жүйенің тұрақты көлемінде коллоидтық бөлшектердің концентрациясының өзгеруін айтады.
деп- бірлік уақытта жүйенің тұрақты көлемінде коллоидтық бөлшектердің концентрациясының өзгеруін айтады. . Мұндағы
. Мұндағы  - бөлшектердің концентрациясы,
- бөлшектердің концентрациясы,  - уақыт.
- уақыт. ” таңбасы бөлшектердің концентрациясы уақыт бойынша азаятынын, ал коагуляция жылдамдығы әрқашанда оң болатынын көрсетеді.
” таңбасы бөлшектердің концентрациясы уақыт бойынша азаятынын, ал коагуляция жылдамдығы әрқашанда оң болатынын көрсетеді.
 болса, онда коагуляция болмайды, коллоидты ерітінді агрегаттық тұрақты болады.
болса, онда коагуляция болмайды, коллоидты ерітінді агрегаттық тұрақты болады. болса, онда жүйелі коагуляция болады, яғни бөлшектердің әрбір соқтығысуы олардың бірігуіне әкеп соғады.
болса, онда жүйелі коагуляция болады, яғни бөлшектердің әрбір соқтығысуы олардың бірігуіне әкеп соғады. болса, онда баяу коагуляция байқалады, яғни бөлшектердің соқтығысуларынан кейбіреулері ғана олардың бірігуіне әкеп соғады.
болса, онда баяу коагуляция байқалады, яғни бөлшектердің соқтығысуларынан кейбіреулері ғана олардың бірігуіне әкеп соғады.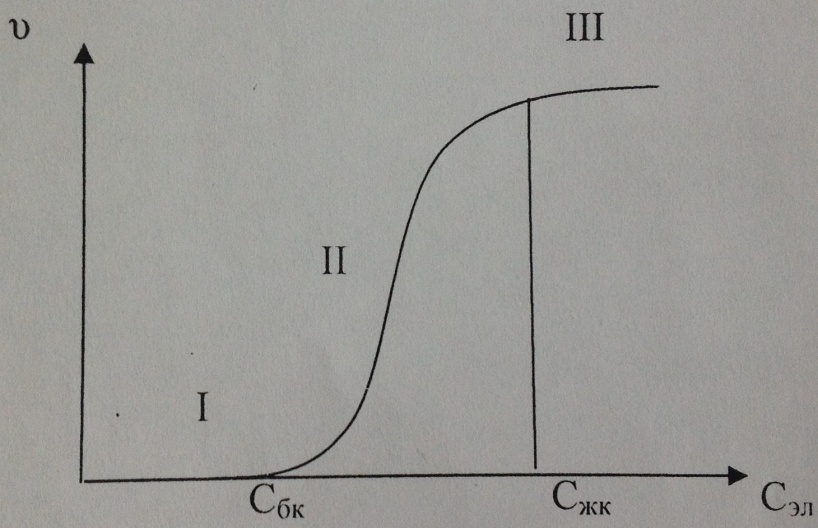
 . Ендеше кинетикалық энергия
. Ендеше кинетикалық энергия  (мұндағы к- Больцман тұрақтысы) болғандықтан лиофобтық кірне агрегаттық тұрақты болады.
(мұндағы к- Больцман тұрақтысы) болғандықтан лиофобтық кірне агрегаттық тұрақты болады.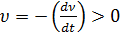 ;
;  , яғни коагуляцияның потенциалдық асуы (тосқауылы) көп шама, бірақ коллоидтық бөлшектердің кинетикалық энергиясымен шамалас және электролит- коагулянт концентрациясы артқан сайын ол азаяды да, ал коагуляция жылдамдығы өседі. Сбк- баяу коагуляцияның табалдырығы, Сжк- жылдам коагуляцияның табалдырығы. Қисықтық бұл аймағы мынадай тәуелділікті өрнектейді:
, яғни коагуляцияның потенциалдық асуы (тосқауылы) көп шама, бірақ коллоидтық бөлшектердің кинетикалық энергиясымен шамалас және электролит- коагулянт концентрациясы артқан сайын ол азаяды да, ал коагуляция жылдамдығы өседі. Сбк- баяу коагуляцияның табалдырығы, Сжк- жылдам коагуляцияның табалдырығы. Қисықтық бұл аймағы мынадай тәуелділікті өрнектейді:
 . Бұл аймақта бөлшектердің бір-біріне соқтығысуы олардың біріуіне әкеп соғады, яғни, жылдам коагуляция жүреді.
. Бұл аймақта бөлшектердің бір-біріне соқтығысуы олардың біріуіне әкеп соғады, яғни, жылдам коагуляция жүреді.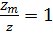
 ; мұндағы К- коагуляция жылдамдығының константасы.
; мұндағы К- коагуляция жылдамдығының константасы.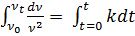
 (1.9)
(1.9) - уақыт t=0 кезіндегі кірне бөлшектерінің концентрациясы;
- уақыт t=0 кезіндегі кірне бөлшектерінің концентрациясы;  уақытындағы кірне бөлшектерінің концентрациясы.
уақытындағы кірне бөлшектерінің концентрациясы.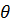 пайдаланылады. Коагуляция периоды
пайдаланылады. Коагуляция периоды  болғанда
болғанда  (1.10)
(1.10) *D (1.11)
*D (1.11) (1.12)
(1.12) еске алатын көбейтіндісін енгізді:
еске алатын көбейтіндісін енгізді:  (1.13)
(1.13) Na- Авогадро саны.
Na- Авогадро саны. потенциалына тәуелді болады.
потенциалына тәуелді болады. - дисперстік фаза бөлшектерінің тығыздығын;
- дисперстік фаза бөлшектерінің тығыздығын;  - дисперстеуші ортаның тығыздығын;
- дисперстеуші ортаның тығыздығын;  - дисперстеуші ортаның тұтқырлығын; V-бөлшектің көлемін білу керек.
- дисперстеуші ортаның тұтқырлығын; V-бөлшектің көлемін білу керек. болса), иә бетке қалқап шығуы мүмкін ( егер
болса), иә бетке қалқап шығуы мүмкін ( егер  болса).
болса). (1.5)
(1.5) ; мұндағы
; мұндағы  (1.6)
(1.6) , үйкеліс коэффициенті Стокс заңы бойынша
, үйкеліс коэффициенті Стокс заңы бойынша  . Бұл өрнектерді (1.6) теңдеуге койсақ: ісед.=
. Бұл өрнектерді (1.6) теңдеуге койсақ: ісед.=  (1.7)
(1.7) , мұндағы
, мұндағы 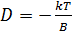
 ; яғни
; яғни  ; ендеше:
; ендеше:  .
.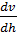 мәндері аз, ал
мәндері аз, ал  және
және  мәндері көп болуы керек. Реалды жағдайларда бұл параметрлерді айтарлықтай өзгерту қиынырақ, ол дисперстік жүйелердегі бөлшектердің радиусы кең аралықта: 10-7-нен 10-2 см-ге дейін өзгереді, сондықтан радиус шешуші роль атқарады. Қарастырылып отырған теңсіздік
мәндері көп болуы керек. Реалды жағдайларда бұл параметрлерді айтарлықтай өзгерту қиынырақ, ол дисперстік жүйелердегі бөлшектердің радиусы кең аралықта: 10-7-нен 10-2 см-ге дейін өзгереді, сондықтан радиус шешуші роль атқарады. Қарастырылып отырған теңсіздік  см болғанда байқалады. Бұл жағдайларда диффузияны елемеуге болады. Ендеше жылдам седиментация жүреді де, жүйе седиментациялық тұрақсыз болады.
см болғанда байқалады. Бұл жағдайларда диффузияны елемеуге болады. Ендеше жылдам седиментация жүреді де, жүйе седиментациялық тұрақсыз болады. ; яғни
; яғни  ; ендеше:
; ендеше:  см болғанда орын алады. Бұл жағдайда седиментацияны елемеуге болады да, ал диффузия бөлшектердің ыдыстың бүкіл көлеміне бірқалыпты таралуын болдырады. Дисперстік жүйе бұл жағдайда седиментациялық тұрақты болады.
см болғанда орын алады. Бұл жағдайда седиментацияны елемеуге болады да, ал диффузия бөлшектердің ыдыстың бүкіл көлеміне бірқалыпты таралуын болдырады. Дисперстік жүйе бұл жағдайда седиментациялық тұрақты болады. , яғни
, яғни  , ендеше
, ендеше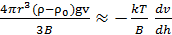



 - ыдыстың түбіндегі бөлшектер концентрациясы;
- ыдыстың түбіндегі бөлшектер концентрациясы;  ыдыс түбінен
ыдыс түбінен  биіктіктегі бөлшектер концентрациясы; А- берілген жүйе үшін тұрақты сан.
биіктіктегі бөлшектер концентрациясы; А- берілген жүйе үшін тұрақты сан.
 немесе:
немесе: 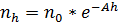 (1.8)
(1.8) см болғанда байқалады.
см болғанда байқалады. ; ал тұтқырлығы
; ал тұтқырлығы  . 1-ші кестеде дисперстік фаза бөлшектерінің радиусына байланысты седиментация туралы мәліметтер келтірілген.
. 1-ші кестеде дисперстік фаза бөлшектерінің радиусына байланысты седиментация туралы мәліметтер келтірілген. 10-3 см) седиментациялық тұрақсыз жүйелер, оларда жылдам седиментация болады.
10-3 см) седиментациялық тұрақсыз жүйелер, оларда жылдам седиментация болады. ) сәулелендіру, механикалық әсерлер, электролит қосу және т.б.
) сәулелендіру, механикалық әсерлер, электролит қосу және т.б.
 ). Коагуляция табалдырығына кері шаманы электролиттің коагуляциялық қабілеттілігі деп аталады кейде оны коагуляция күші (Р) деп те атайды). Әрине бүл айтылған шамалар бірдей электролиттер үшін әртүрлі кірнелерде әртүрлі болады.
). Коагуляция табалдырығына кері шаманы электролиттің коагуляциялық қабілеттілігі деп аталады кейде оны коагуляция күші (Р) деп те атайды). Әрине бүл айтылған шамалар бірдей электролиттер үшін әртүрлі кірнелерде әртүрлі болады. немесе
немесе 