|
|
Электролитпен коагуляциялау кинетикасы 10 глава1.3 Коллоидтық химияның зерттейтін нысандарының басты белгілері Сонымен «Коллоидтық химия» пәнінің зерттейтін нысандарының басты екі белгісі болады екен: 1) гетерогенділігі және 2) дисперстілігі. Гетерогенділік жүйеде фазааралық бөлу беті болатынын, яғни жүйе гетерогенді екендігін көрсетеді. Гетерогендік белгісі фазааралық бөлу бетінде өтелмеген күш өрісінің болу шарты болып саналады. Бұл күш өрісі фазааралық керілудің шамасы арқылы сипатталады. Фазааралық керілу азайған сайын екі фазаның өзара әрекеттесуі күшейеді. Беттік керілудің бет ауданына көбейтіндісі беттің еркін энергиясына тең болады:
Gs = s S
Мұндағы s - беттік керілу, Дж/м2; S - беттің ауданы, м2.
Коллоидтық химия фазааралық бөлу беттеріндегі жүретін үдерістерді зерттейді. Демек, гетерогенділік коллоидтық химияның зерттейтін нысандарының маңызды белгісі болып саналады. Дисперстілік (ұсақтылық) – дененің кеңістіктегі (үш бағыттағы) өлшемімен анықталады. Зат әртүрлі пішінде (дисперсияда): шар, цилиндр, тік төртбұрышты, ал көбінесе бұрыс пішінде болуы мүмкін. Әртүрлі дисперсиялардың түзілуін дененің өлшемін үш бағытта өзгерте отырып қарастыруға болады. Мысалы, дененің өлшемі бір бағытта - ОУ бойымен (1.2-сурет) кемігенде қалыңдығы а-ға тең қабыршық түзіледі. Қабыршық қалыңдығы арқылы сипатталады.
1.2-сурет. Дененің өлшемінің кеңістікте үш бағытта өзгеруіне байланысты пішіні Дененің өлшемі екі бағытта (ОУ және ОХ бойымен) кішірейгенде түтікше (жіп) түзіледі. Түтікше өзінің диаметрі арқылы сипатталады. Ал дененің өлшемі үш бағытта кішірейгенде (ОУ, ОZ және ОХ бойымен) онда ұсақ бөлшек түзіледі. Ұсақ бөлшектер пішініне қарай диаметрі (шар тәрізді бөлшектер) немесе қабырғасының ұзындығы (куб, параллелипед тәрізді бөлшектер) арқылы сипатталады. Дисперстілік (ұсақтылық) дененің өлшемінің (a) кері шамасына тең:
D = 1 / a Дисперстіліктің СИ жүйесіндегі өлшем бірлігі - м-1.
Мысалы, бөлшек шар тәрізді болса, онда дисперстілік оның диаметрі, ал тік төртбұрышты болса оның қабырғасының ұзындығы арқылы анықталады. Бөлшектің ұсақтығын оның меншікті бетінің ауданы (Sмен ) арқылы да сипаттауға болады:
S мен = S / V.
Мұндағы S пен V – бөлшек бетінің ауданы мен көлемі. Меншікті бетінің өлшем бірлігі – м-1. Мысалы, радиусы r -ға теңшар тәріздес бөлшек бетінің ауданы S=4pr2, ал көлемі V=4pr3/3 екендігін ескерсек, онда оның меншікті бетінің ауданы мынаған тең болады:
Мұндағы d – бөлшектің диаметрі, м.
Ал қабырғасының ұзындығы а-ға тең квадрат пішінді бөлшектің меншікті бетінің ауданы мына теңдеумен анықталады:
Сонымен бірге, дененің меншікті бетінің ауданын оның бірлік массасына шағып та есептеуге болады. Ол кезде Sмен мәні келесі теңдеу арқылы есептеледі:
Мұндағы r - бөлшектің тығыздығы, кг/м3. Сонда меншікті беттің өлшем бірлігі – м2/кг болады. Осы коллоидтық химия нысандарының басты екі ерекше белгісін еске ала отырып, әрі қысқа, әрі нұсқа приципі тұрғысынан берілген академик В.П. Ребиндердің анықтамасы бойынша: коллоидтық химия-беттік құбылыстар мен дисперстік жүйелердің физика-химиясы.
1.4 Коллоидтық және дисперстік жүйелердің жіктелуі. Білімнің қай саласында болса да күрделі құбылыстар мен обьектілерді қарастырған кезде жеңілдету және кейбір заңдылықтарды табу үшін оларды әр түрлі белгілермен жіктейтінін білеміз. Сол мақсатпен дисперстік жүйелерді де жіктеген жөн. Әр кезде коллоидтық және дисперстік жүйелерді әр түрлі принциптермен жіктелінеді. Бірақта дисперстік жүйелердің осы уақытқа дейін (бірыңғай) біртұтас жіктелуі жоқ. Оның себебі дисперстік жүйелерді жіктеу кезінде олардың барлық қассиеттерін қарастырмай, тек кебіреулеріне ғана тоқталады. Төменде сол әр түрлі принципке негізделген дисперстік жүйелердің жіктелуіне қысқаша тоқталайық. 1.4.1 Дисперстілік көрсеткіші немесе дисперстік бөлшектердің өлшемі бойынша жіктеу Бұл жөнінде жоғарыда да аздап қарастырған болатынбыз (1.1 – суретті қара). Дисперстілік бойынша алғаш Зидентопф пен Зигмонди микроскоп көрінетін бөлшектерді микрондар, ал көрінбейтіндерді ультрамикрондар деп атауды ұсынды. Ультрамикрондардың өзін субмикрондар және амикрондар деп екіге бөлді. Субмикрондарға ультрамикроскоп көмегімен байқалатын, яғни өлшемі 5÷200 нм болатын бөлшектерді, ал амикрондарға ультрамикроскоппен байқалмайтын бөлшектерді жатқызды. Соңғы кездерде бұл терминдер қолданылмайды деуге болады. Дисперстік фаза бөлшектерінің өлшемі (көлденең қимасы) 10-3 см-ден жоғары болса, немесе дисперстілігі 103 см-1-ден аз болса, ондай дисперстік жүйелерді макрогетерегендік жүйелер (дөрекі дисперстік жүйелер) деп атайды. Егер бөлшектердің дисперстілігі 103-105 см-1 аралығында болса, онда оларды микрогетерегендік жүйелер деп атайды. Егер дисперстік фаза бөлшектердінің шамасы 10-5-10-7 см немесе дисперстілігі 105-107 см-1 аралығында болса оларды ультрамикрогетерогендік (немесе коллоидтық) жүйелер деп атайды. Дисперстік фаза бөлшектері атом, молекула, иондардың өлшеміндегі дәрежеде, яғни Д>107 см-1 болса оларды молекулалық-иондық дисперленген немесе гомогендік жүйелер деп атайды. Макрогетерогендік жүйелердегі бөлшектерді қарапайым көзбен, ал микрогетерогендік жүйелерді микроскоппен көруге болатын болса, ал ультрамикрогетерогендік (коллоидтық) жүйелердің бөлшектерін тек ультрамикроскоп арқылы байқауға болады.
1.4.2 Дисперстік фаза мен дисперсиялық ортаның агрегаттық күйіне байланысты жіктеу Бұл жіктеуді Во. Оствальд жасаған болатын. Олардың кестеде көрсеткендей 9 жағдайын қарастыруға болады.
4- кесте. Агрегаттық күйі бойынша жіктеу
Дисперстілік дәрежесі коллоидтық бөлшектерге сәйкес келетін жүйелерді коллоидтық химияда зольдер(қазақша:кірнелер)деп атайды. Дисперсиялық орта газ болған жағдайда оларды- аэрокірнелер деп атайды, егер сұйықтық болса лиокірнелер деп атайды. (Грекше лиос – сұйық) сұйықтықтың табиғаттына байланысты лиокірнелер – гидрокірне, алкокірне, этерокірне, бензокірнелер болып бөлінеді (оларға сәйкес дисперсиялық орта – су, спирт, эфир, бензол). Егер коллоидтық жүйенің дисперсиялық ортасы органикалық сұйықтық болса, онда оларды органокірнелер деп жалпы атай береді. Дисперстік фаза қатты, ал дисперсиялық ортасы сұйық болып келген микрогетерогендік жүйелерді жүзгіндер (суспензиялар) деп атайды. Во. Оствальдтің осы жіктеуін Зигмонди дисперсиялық ортаның агрегаттық күйіне байланысты үш-ақ топқа бөлді. Сұйық, газ және қатты ортадан тұратын жүйелер. Бұларды қысқаша лиокірне, аэрокірне және солидо (иә криокірнелер) деп те атайды.
1.4.3 Дисперстік фаза мен дисперсиялық ортаның әрекеттесуі немесе дисперстік жүйелердің термодинамикалық тұрақтылығы бойынша жіктеу Бұл жіктеу дисперсиялық орта сұйықтық болғанда ғана қолданылады. Жәйлап сұйықтықты (ұшырған) кептірген кезде қалған құрғақ қалдықтың таза дисперсиялық ортада еру ерімеуіне байланысты Зигмонди коллоидтық жүйелерді 2 топқа бөлді. Құрғақ қалдық дисперсиялық ортада өздігінен еріп дисперленбесе оны қайтымсыз деп, ал егер құрғақ қалдық дисперсиялық ортада алдымен ісініп, кейіннен өзбетінше еріп кетсе, оны қайтымды жүйелер деп атады. Қайтымсыз жүйелерге металдардың кірнелері, АgJ кірнелері т.б. жатады, ал қайтымды жүйелерге желатиннің судағы, каучуктің бензолдағы ерітінділері жатады. Фрейндлих ойы бойынша коллоидтық жүйенің қайтымды, иә қайтымсыз болуы сол жүйені түзетін дисперстік фаза мен дисперсиялық ортаның өзара әрекеттесу қабілеттеріне байланысты. Қайтымды жүйенің дисперстік фазасы молекулалық түрде дисперсиялық ортамен әрекеттеседі, сондықтанда онда ериді. Осыған байланысы бұндай коллоидтық жүйені Фрейндлих лиофильдік коллоидтық жүйе деп атады (грекше лиос – сұйық, фило – ұнатамын). Лиофильдік жүйелер – термодинамикалық тұрақты жүйелер. Олар өз бетімен түзіледі, түзілу кезінде жүйенің еркін (Гиббс) энергиясы азаяды, яғни Қайтымсыз коллоидтық жүйенің дисперстік фазасы ортамен әрекеттеспегендіктен онда ерімейді. Оларды Фрейндлих лиофобтық жүйелер деп атады (фобо – ұнатпайтын). Лиофобтық жүйелер – термодинамикалық тұрақсыз жүйелер. Олар ұзақ өмір сүре алмайды. Оларға жүзгіндер (суспензиялар),майғындар (эмульсиялар), көбіктер және т.б. жатады. Лиофобтық жүйелерді тұрақтандыру үшін оларға тұрақтандырғыштар (стабилизаторлар) қосады. Мысалы тұрақтандырғыш рөлін электролиттер, бетті-активтік заттар, үлкен молекулалық қосылыстар және т.б. заттар атқарады. Егер дисперстеуші орта су болатын болса, онда аталған жүйелер жоғарғы терминдерге сәйкес гидрофильдік және гидрофобтық коллоидтық жүйелер деп аталады. Зигмонди мен Фрейндлих үлкен молекулалық заттардың ерітіндісін коллоид деп қарастырған болатын. Сондықтан бұл жіктеу тек коллоидтық жүйе емес, коллоидтық жүйеге сәйкес келетін ҮМҚ, яғни полимерлердің ерітінділерін де қамтиды.
1.4.4 Дисперстік фазаның бөлшектерінің өзара әрекеттесуі немесе дисперстік фазаның кинетикалық қасиеті бойынша жіктеу Бұл жіктеу бойынша дисперстік жүйелер дербес (бос) дисперстік және байланысқан дисперстік жүйелер болып екіге бөлінеді. Дербес дисперстік жүйелерге бөлшектер арасында байланыс болмайтын, броун қозғалысы, иә салмақ күші бойынша дисперстік ортада тәуелсіз қозғалатын құрылымсыз жүйелер жатады. Бұндай жүйелер қозғау күшіне кедергі жасамайды, аққыштық т.б. сұйыққа тән қасиеттер көрсетеді. Оларға мысалы, лиокірнелер өте сұйылтылған жүзгіндер мен майғындар, аэрокірнелер жатады. Байланысқан дисперстік жүйелерде бөлшектер өзара молекулалық күштер бойынша байланысқан. Олар дисперсиялық ортада өздеріне тән кеңістік тор/құрылым/ түзеді. Сол себептен олардың жылжуы қиынға соғып, олар тек тербелісті қозғалыста болады. Бұларға концентрлі жүзгіндер мен майғындар жатады. Олар жартылай қатты дененің қасиеттеріндей қасиет көрсетеді. Бірақ оларды дисперсиялық ортасы қатты дене боп келетін жүйелермен шатыстырмау керек. Бұл соңғы жағдайда бөлшектер бір біріне салыстырмалы түрде қозғалмайды, бірақ бұның себебі дисперсиялық ортаның тұтқырлығының өте жоғары болуына байланысты. Бұл соңғы жіктеу тек коллоидтық жүйеге ғана емес ҮМҚ ерітінділеріне де қолданылады. ЕКІНШІ ТАРАУ 2 КОЛЛОИДТЫҚ ЖҮЙЕЛЕРДІҢ ОПТИКАЛЫҚ ҚАСИЕТТЕРІ Коллоидтық жүйелердің оптикалық қасиеттерін зерттеудің сол жүйелердегі бөлшектердің шамасы мен құрылымын, пішіні мен концентрациясын анықтау үшін маңызы зор. Жарық сәулесі кез келген жүйелерге түскенде мынадай құбылыстардың бірін байқауға болады: 1) Жарықтың жүйеден өтуі; 2) Жарықтың дисперстік фаза бөлшектерімен сынуы; 3) Шағылуы(дисперстік фаза бөлшектерімен); 4) Шашырауы (бұл құбылыс опалесценция күйінде байқалады); 5) Жарықтың абсорбциясы(жұтылуы). Дисперстік фазада жарық жұтылғанда жарық энергиясы жылулық энергияға айналады. Жарықтың өтуі молекулалық ерітінділерге тән, ал оның сынуы мен шағылуы микрогетерогендік жүйелерде байқалады, сондықтанда олар лайланып (күңгірттеніп) көрінеді.Коллоидтық жүйелер үшін тән қасиеттер – жарықтың шашырауы мен жұтылуы. Жоғары құбылыстардың алғашқы үшеуі физика курсында баяндалатындықтан, соңғы екі құбылысқа тоқталайық.
2.1 Жарықтың шашырауы (опалесценция) Коллоидты-дисперстік жүйелерде бөлшектер өздерінің шамасы жағынан жарық толқының ұзындығынан кіші, сондықтан да олар жарықты шағылыстырмайды, сол себепті жайшылықта мұндай мұндай жүйелер мөлдір болады. Мысалы, коллоидтық жүйелердің бөлшектер шамасы 0.1 мк, ал жарық толқынының ұзындығы 0.4 мк мен 0.7 мк аралығында. Егер қараңғыда линзалардың көмегімен бір шоғыр жарық сәулесін мөлдір коллоидтық жүйеге бір жағынан түсірсек, онда конус тәрізді эффектіні байқауға болады. Мұның себебі – жарық сәулесінің коллоидтық бөлшектердің әсерінен шашырауы. Жарықтың өте ұсақ бөлшектерде шашырауын алғаш М.В. Ломоносов көрсеткен болатын. Бұл құбылысты жүйелік түрде зерттеу өткен ғасырдың орта шенінде басталды (Мысалы, Брюкке 1852 ж.; Фарадей-1857 ж. Тиндаль-1869 ж.). Коллоидтық алтынның жарықты шашыратуын толығырақ зерттеген Фарадей және оның шәкірті Тиндаль болғандықтан, жарық шашырауынан болған коллоидтық ерітіндегі жарқыраған конусты- Фарадей-Тиндаль конусы, ал құбылысты – Фарадей-Тиндаль эффектісі деп атайды (2.1 – суретті қара). Бұл кезде жарық сәулесі шағылыспай, коллоидтық бөлшектерді айналып өтеді (дифракцияланады), яғни шашырайды.
2.1cурет. Фарадей – Тиндаль эффектісі. А- жарық көзі, В- линза, С- коллоидтық ерітінді Жарықтың шашырау қарқындылығы тек жарық толқынының ұзындығы, коллоидтық бөлшектің шамасына ғана емес т.б. көптеген факторларға байланысты болады. Осы факторлардың арасындағы байланысты, жарық шашырауының теориясын жасаған ағылшын физигі Рэлейдің (1871-1899 жж.) теңдеуі арқылы көрсетуге болады:
Мұнда, n1,n0-дисперстік фаза мен дисперсиялық ортаның сыну көрсеткіштері.
V-1 бөлшектің көлемі.
α-түскен және шашыраған сәуленің арасындағы бұрыш.
Бұл теңдік бөлшектерінің пішіні шар тәрізді, шамалары жарық толқынының ұзындығынан кіші, электр тоғын өткізбейтін және бір-бірінен арасы қашықтау (сұйылтылған) жүйе болғанда ғана қолданылады. Басқа уақытта жағдайдың өзгеруін есепке алу керек, сол себептен жоғарғы формулада кейбір шамалардың дәрежесі мен коэффицентердің мәні өзгереді. Рэлейдің формуласынан мынадай қорытындылар шығаруға болады: 1) Егер бөлшектердің шамасы бірдей болса, шашыраған сәуленің қарқындылығы сол кірне (золь) концентрациясына тура пропорциональды байланыста өзгереді. 2) Жарық шашырау қарқындылығы бөлшектердің көлемінің квадратына, ал егер бөлшектер шар тәрізді болса радиустың 6- дәрежесіне тура пропорционал. Егер зольдің салмақтық концентрациясы өзгермесе, онда бөлшектердің кішіреюіне байланысты жарықтың шашырауы да кемиді. Егер бөлшектер шамасы өте көп болып, толқын ұзындығын да асса, онда жарық шағылысады да, шашырау қарқындылығы азаяды.Оны график түрінде былай көрсетуге болады.
2.2- сурет. BaSO4 жүзгіндегі жарықтың шашырауы
3) Жарық шашыраған кезде түссіз коллоидтық жүйе көгілдір тартады. Сондықтан да жарықтың шашырауын басқаша опалесценция деп атайды. (opalys- сарғыш-көгілдір түсті минералдың латынша аты). Ір мен λ4 кері пропорционал болғандықтан, жарықты күлгін түсті сәуле (қысқа толқынды сәуле) көбірек шашыратады. Аспанның және теңіз суларының көк болуы жарықтың шашырау құбылысына байланысты. Жарықтың шашырауының толқын ұзындығына байланыстылығы практикада қызыл жарықты сигнализация (светофорларды, фонарьларда, самолеттерде) т.б. қолданылады.Егер самолеттерді байқатпау керек болса жасыл жарық қолданылады. 4) ҮМҚ ерітіндісіне қарағанда кірнелердің (әсіресе, металдық) опалесценциясы күштірек. Олай болуы зольдердің тығыздығының, соған сәйкес сыну көрсеткіштерінің мәні үлкен шама. 5) Шын ерітінділерде жарықтың шашырауы өте нашар. Оның себебі 2.1.1 Опалесценция және флуоресценция Опалесценция деп коллоидтық жүйелердің жарықты шашыратуын айтады. Сырт жағынан опалесценцияға ұқсас флуоресценция деген құбылыс бар. Флуоресценция кейбір шын ерітінділерде,мысалы, флуоресцейн, эозин ерітінділерінде байқалады. Сырт жағынан ұқсас деп отырғанымыз, опалесценцияда да, флуоресценцияда да Фарадей-Тиндаль конусын байқауға болады. Алайда, бұл құбылыстардың табиғаты әрқалай. Флуоресценция-кейбір заттардың жарық толқындарын таңдамалы түрде (іріктеп) жұтуына байланысты болатын ішкі молекулалық құбылыс. Жарық затпен жұтылады да, басқа жиілікпен тербелетін болғандықтан трансформацияланады. Флуореценция беретін заттардан шыққан кезде сәуленің толқын ұзындығы әрқашанда түскен сәуленің толқын ұзындығынан ұзын болады. Мысалы, ақ жарық фотонын hy десек, оның бірнеше спектрлердің жиынтығы екенін ескеріп, мынадай өрнек жазуға болады: hν= hν1 + hν2 + hν3 + ….. (1)
Бұл теңдеуден: ν= ν1 + ν2 + ν3 + .... (2)
болатыны көрініп тұр. Ендеше:
(3) және с.с. Жарықтың толқын ұзындығы (λ) мен жиелігі ( (ν= (3) теңсіздіктерін төмендегідей етіп жазуға болады:
λ <λ1 ; λ<λ2 ; λ<λ3 және с.с. (4)
Флуоресценция құбылысы кезінде зат жарық толқын ұзындығын таңдамалы жұтатындықтан, жарық түскен сәулеге қарағанда басқа, атап айтқанда жиілігі аз, сәулемен шығады. Ендеше түскен сәулеге қарағанда әрқашанда шыққан сәуленің толқын ұзындығы көбірек болады. Егер опалесценцияны, кез-келген ұзындықтағы жарық сәулесі беретін болса, флуоресценцияны флорестейтін затта тән белгілі бір толқын ұзындығындағы жарық сәулесі береді. Осыған байланысты опалесценцияны флуоресценциядан жарық жолына жарық сүзгілерін қою арқылы ажыратуға болады. Көбінде флуоресценцияны толқын ұзындығы кіші болатын сәуленің спектрлері беретін болғандықтан, егер сәуле жолына қызыл жарық фильтрін (жарықсүзгіш) қойсақ, онда флуоресценция болмауға тиіс, ендеше жарқылдайтын конусты көре алмаймыз. Керісінше опалесценцияда Фарадей- Тиндаль эффектісін байқауға болады.
2.1.2 Коллоидтық жүйедегі шашыраған жарықтың поляризация мен индикатриссасы Шашыраған жарық барлық бағытта тарайды. Оның қарқындылығы әр бағытта әртүрлі болады. Қарқындылығы ең күшті шашыраған жарық 00 пен 1800 бағытында болады. Шашыраған жарық көбінде поляризацияланған болып келеді. Поляризациялану көрсеткіші әр бағытта әртүрлі және бөлшектің пішініне де байланысты болады. Мысалы, өте ұсақ бөлшектер үшін, 00 пен 1800 бағытымен шашыраған жарықтар поляризацияланбайды да, ал 900 бағытымен шашыраған жарық толық поляризацияланады. Ал ірілеу бөлшектер үшін поляризациялану көрсеткіші 900 градустан басқа бағытта көбірек болады. |
|

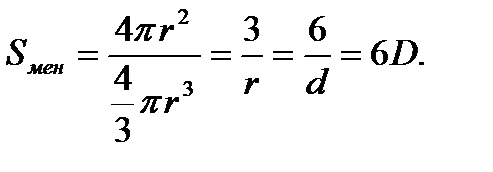
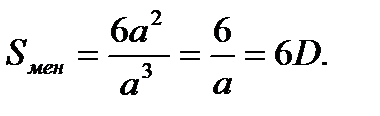
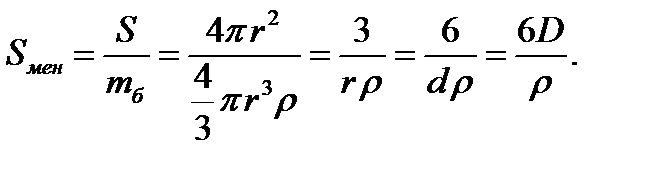
 . Мұндай жүйелерге бетті-активтік заттардың мицеллярлық ерітінділері, үлкен молекулалық қосылыстардың ерітінділері және бентонит сазбалшықтарының суспензиялары жатады. Оларға агрегаттық тұрақтылық тән болады.
. Мұндай жүйелерге бетті-активтік заттардың мицеллярлық ерітінділері, үлкен молекулалық қосылыстардың ерітінділері және бентонит сазбалшықтарының суспензиялары жатады. Оларға агрегаттық тұрақтылық тән болады.

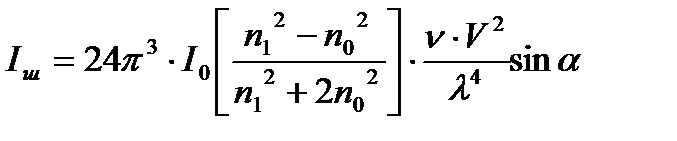
 -сандық концентрация (1см3 көлемдегі бөлшектер саны)
-сандық концентрация (1см3 көлемдегі бөлшектер саны) - жарық толқынының ұзындығы.
- жарық толқынының ұзындығы.
 V2 өрнегі өте аз шама. Алайда егер шын ерітінді арқылы қысқа толқынды сәуле өтсе (мысалы, рентген сәулесі) онда да опалесценцияны байқауға болады.
V2 өрнегі өте аз шама. Алайда егер шын ерітінді арқылы қысқа толқынды сәуле өтсе (мысалы, рентген сәулесі) онда да опалесценцияны байқауға болады. ;
;  ;
; 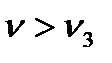
 ) бір-біріне кері пропорционал болғандықтан
) бір-біріне кері пропорционал болғандықтан ) (3)
) (3)