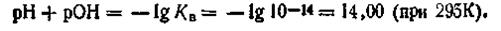|
|
Ионное произведение воды. Понятие о рН как показателе реакции среды.Вода является средой, в которой протекают самые разнообразные химические процессы. Она обладает хорошей растворяющей способностью и вызывает электролитическую диссоциацию многих растворенных в ней веществ. Более того, химически чистая вода сама является слабым электролитом и подобно кислотам, основаниям и солям частично диссоциирует на ионы:
Ионы водорода легко гидролизуются, образуя ионы гидроксония Н3О+, которые в дальнейшем изложении мы ради простоты будем обозначать как Н+. Тщательно очищенная вода, как показал Кольрауш, обладает очень незначительной электрической проводимостью. Константа электролитической диссоциации воды, выражаемая согласно закону действующих масс уравнением
при 295К составляет 1,8·10-16, а степень диссоциации 1,7·10-9. Учитывая столь незначительную степень диссоциации воды (из 555 млн. молекул ее только одна диссоциирует на ионы), концентрацию недиссоциированных молекул можно приравнять к общему количеству воды и считать ее постоянной величиной, т. е. [Н2О] = const. В связи с этим уравнение (4.48) можно представить в виде
где Кв— ионное произведение воды. Поскольку в литре воды находится 1000/18 = 55,6 моль H2O, то, подставляя это значение, а также численное значение константы диссоциации воды в уравнение (4.49), получим
Таким образом, в любом водном растворе при постоянной температуре произведение концентраций (точнее, активностей) ионов водорода и гидроксид-ионов сохраняет вполне определенное, постоянное значение, равное ионному произведению воды. Здесь необходимо еще раз напомнить, что эта закономерность справедлива для очень разбавленных растворов, для которых активности практически равны аналитическим концентрациям. Для растворов электролитов обычных концентраций только величина произведения активностей ионов ан+аон-, а не произведение концентраций [Н+][ОН-] является постоянной величиной, т. е.
В уравнении ионного произведения воды [Н+] или [ОН-] никогда не могут быть равными нулю, так как любая величина, умноженная на ноль, дает ноль. С другой стороны, если концентрация (активность) одного иона стремится к нулю, т. е. становится бесконечно малой величиной, то в этом случае концентрация (активность) другого иона должна быть бесконечно большой величиной, что не имеет никакого физического смысла. Однако если в воде будет растворена кислота и тем самым повысится содержание Н+ ионов, концентрация гидроксид-ионов должна понизиться так, чтобы сохранилось постоянное значение КВ, равное при 295 К всегда 10-11. Совершенно аналогичное действие произойдет при введении в раствор щелочи. От избытка гидроксид-ионов значение КВ должно остаться прежним. Иными словами, численное значение КВ не зависит от природы растворенного вещества, поскольку [Н+] и [ОН-] являются величинами сопряженными. Опыт показывает, что диссоциация воды представляет собой эндотермический процесс, поэтому в соответствии с принципом Ле Шателье при повышении температуры равновесие будет смещаться в сторону образования ионов, что повлечет за собой увеличение КВ, при Из курса неорганической химии известно, что все свойства, характерные для кислот, зависят от наличия в растворе ионов водорода Н+ (точнее, ионов гидроксония Н3О+), а свойства, характерные для щелочей, — от гидроксид-ионов ОН-. Поэтому растворы, в которых [Н+] = [ОН-], называются нейтральными; если [Н+]>[ОН-], растворы называются кислыми, и если [H+]<[OH-], то раствор щелочной. Чистая вода имеет нейтральную реакцию, потому что в ней [Н+] = [ОН-] = √10-14 = 10-7 моль/л (при 295 К). Концентрации Н+, с которыми приходится иметь дело на практике, обычно выражаются весьма малыми величинами. Так, желудочный сок, являющийся самой кислой жидкостью организма человека, имеет концентрацию Н+ -ионов около 10-1 моль/л, концентрация Н+-ионов в слюне — около 10-2 моль/л и т. д. Как видим, характеризовать кислотность или щелочность растворов числами с отрицательными показателями степени (10-5, 10-12) практически неудобно. Поэтому реакцию водных растворов, показывающую степень их кислотности или щелочности, принято выражать не концентрацией (или активностью) ионов Н+ или ОН-, а так называемым водородным показателем рН. Показатель водородных ионов (рН) впервые был предложен как условное обозначение в 1909 г. Зеренсеном (р — первая буква слова potenz); он определяется общей формулой
адля разбавленных растворов
Следовательно, водородным показателем называют величину, численно равную отрицательному десятичному логарифму концентрации (или активности) водородных ионов, выраженной в моль на литр. Для абсолютно чистой воды при 295 К рН = — lg 10-7 = 7. Для кислых растворов рН<7, а для щелочных рН>7. Логарифмируя ионное произведение воды, т. е. уравнение (4.51), получим Изменив знаки на обратные, запишем: —lg[H+]—lg[OH-] = =-lgl0-14. Учитывая, что —lg[H+] = pH, a —lg[OH-] = pOH, будем иметь
Если —lgКв как постоянную величину обозначить через рКв, то выражение примет вид
Зная концентрацию (активность) водородных ионов Н+ в растворе, можно определить водородный показатель (рН) и, наоборот, можно определить концентрацию Н+-ионов по известному значению рН.
|
|