|
|
Диффузионный потенциал. Биологическое значение диффузионных и мембранных потенциалов.Говоря о гальваническом элементе, мы рассматривали только границу раздела металл — раствор его соли. Теперь обратимся к границе раздела между растворами двух различных электролитов. В гальванических элементах на границах соприкосновения растворов могут возникать так называемые диффузионные потенциалы. Они возникают также и на границе раздела между растворами одного и того же электролита в том случае, когда концентрация растворов неодинакова. Причина возникновения потенциала в подобных случаях заключается в неодинаковой подвижности ионов в растворе. Скачок потенциала на границе между неодинаковыми по составу или по концентрации растворами называется диффузионным потенциалом. Значение диффузионного потенциала зависит, как показывает опыт, от различия подвижностей ионов, а также от различия концентраций соприкасающихся растворов. Диффузионный потенциал можно определить экспериментально, а также вычислить. Так, значение диффузионного потенциала (εД), возникающего при соприкосновении растворов различной концентрации одного и того же электролита, дающего однозарядные ионы, вычисляется по формуле
где lк и lа — соответственно подвижности катиона и аниона; a1 и а2 — активности соприкасающихся электролитов, причем а1>а2. Если бинарный электролит дает два однозарядных иона, правая часть выражения (4.96) должна быть разделена на 2. Если соприкасаются между собой два бинарных электролита, дающие однозарядные ионы и имеющие равные концентрации, диффузионный потенциал вычисляется по следующей формуле:
где lК и lа — подвижности ионов одного электролита; lК’ и la’ — подвижности ионов другого электролита. При точных вычислениях э.д.с. гальванических цепей обязательно должна вводиться поправка на величину диффузного потенциала, включая между растворами электролита насыщенный раствор хлорида калия. Так как подвижность ионов калия и хлора примерно одинаковы (l K+ = 64,4 ·10-4 и l Cl- = 65,5 · 10-4 См·м2), то диффузионный потенциал, вызываемый таким электролитом, практически будет равен нулю.
Диффузионный потенциал может сильно возрасти, если растворы электролитов различных концентраций разделить специальной мембраной, проницаемой только для ионов одного какого-то знака. В ряде случаев возникновение мембранного потенциала связано с тем, что поры мембраны не соответствуют размерам ионов определенного знака. Мембранные потенциалы весьма стойки и могут без изменения сохраняться долгое время. В тканях растительных и животных организмов, даже внутри одной клетки, имеются мембранные и диффузионные потенциалы, обусловленные химической и морфологической неоднородностью внутриклеточного содержимого. Различные причины, изменяющие свойства микроструктур клетки, приводят к освобождению и диффузии ионов, т. е. к появлению различных биопотенциалов и биотоков. Роль этих биотоков в настоящее время еще до конца не изучена, но имеющиеся экспериментальные данные свидетельствуют об их важном значении в процессах саморегуляции живого организма.
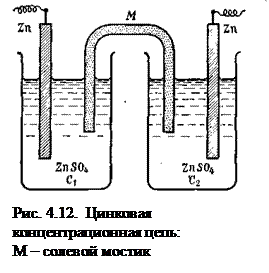
Концентрационные цепи. Известны гальванические элементы, в которых электрическая энергия образуется не за счет химической реакции, а за счет разницы концентраций растворов, в которые опущены электроды из одного и того же металла. Такие гальванические элементы называются концентрационными (рис. 4.12). В качестве примера можно назвать цепь, составленную из двух цинковых электродов, погруженных в растворы ZnSO4 различной концентрации: В этой схеме С1 и С2— концентрации электролитов, причем C1>C2 Поскольку металл обоих электродов один и тот же, стандартные потенциалы их (εoZn ) также одинаковы. Однако из-за различия концентрации катионов металла равновесие
в растворе в обоих полуэлементах неодинаково. В полуэлементе с менее концентрированным раствором (С2) равновесие несколько сдвинуто вправо, т. е.
В этом случае цинк посылает в раствор больше катионов, что приводит к возникновению на электроде некоторого избытка электронов. По внешней цепи они перемещаются ко второму электроду, погруженному в более концентрированный раствор сульфата цинка ZnSO4. Таким образом, электрод, погруженный в раствор большей концентрации (C1), зарядится положительно, а электрод, погруженный в раствор меньшей концентрации, зарядится отрицательно. В процессе работы гальванического элемента концентрация С1 постепенно уменьшается, концентрация С2 увеличивается. Элемент работает до тех пор, пока сравняются концентрации у анода и катода. Вычисление э.д.с. концентрационных элементов рассмотрим на примере цинкового концентрационного элемента. Допустим, что концентрация C1 = l моль/л, а С2 = 0,01 моль/л. Коэффициенты активности Zn2+ в растворах этих концентраций соответственно равны: f1 = 0,061, а f2 = 0,53. Для вычисления э.д.с. цепи воспользуемся уравнением (4.91). На основании уравнения Нернста можем написать
где a1 и а2 — активности катионов Zn2+ в первом и во втором полуэлементах. Подставляя эти значения ε1 и ε2 в уравнение (4.91), получим
Учитывая, что
получим
Таким образом, э.д.с. цинковой концентрационной цепи равна 0,030 В. Общее уравнение для вычисления э.д.с. подобных цепей имеет вид
Из уравнения (4.100) видно, что концентрацию ионов в данном рас- творе можно легко вычислить, если составить цепь, один из электродов которой опущен в исследуемый раствор, а другой— в раствор с известной активностью тех же ионов. Для этой цели необходимо только измерить э.д.с. составленной цепи, что может быть легко сделано с помощью соответствующей установки. Концентрационные цепи широко используются в практике для определения рН растворов, произведения растворимости труднорастворимых соединений, а также для определения валентности ионов и констант нестойкости в случае комплексообразования. Электроды сравнения. Как уже отмечалось, потенциалы различных электродов измеряются по отношению к потенциалу нормального водородного электрода. Наряду с водородным в электрохимии в настоящее время широко применяется другой электрод сравнения — так называемый каломельный электрод, который, как показал опыт, обладает постоянным и хорошо воспроизводимым потенциалом.
Таким образом, платиновая пластинка или проволока, поглотившая молекулярный водород и опущенная в раствор, содержащий ионы водорода, представляет собой водородный электрод. Поскольку сама платина не участвует в электродной реакции (ее роль сводится лишь к тому, что она поглощает водород и, будучи проводником, делает возможным перемещение электронов от одного электрода к другому), химический символ платины в схеме водородного электрода обычно заключают в скобки: (Pt)H2|2H+. Существуют различные конструкции сосудов для водородного электрода, две из которых показаны на рис. 4.13. На поверхности водородного электрода устанавливается равновесие:
В результате этих процессов на границе между платиной и раствором ионов водорода образуется двойной электрический слой, обусловливающий скачок потенциала. Величина этого потенциала при данной температуре зависит от активности водородных ионов в растворе и от количества поглощенного платиной газообразного водорода, которое пропорционально его давлению:
где аН+ - активность водородных ионов в растворе; РН2,— давление, под которым поступает для насыщения электрода газообразный водород. Опыт показывает: чем больше давление для насыщения платины водородом, тем более отрицательное значение принимает потенциал водородного электрода. Электрод, состоящий из платины, насыщенной водородом под давлением в 101,325 кПа и погруженной в водный раствор с активностью ионов водорода, равной единице, называется нормальным водородным электродом. По международному соглашению потенциал нормального водородного электрода условно принят равным нулю, с этим электродом сопоставляют потенциалы всех других электродов. В самом деле, при Рн2,— 101.325 кПа выражение для потенциала водородного электрода будет иметь вид
Уравнение (4.103) справедливо для разбавленных растворов. Таким образом, при насыщении водородного электрода водородом под давлением в 101,325 кПа потенциал его зависит только от концентрации (активности) водородных ионов в растворе. В связи с этим водородный электрод может применяться на практике не только как электрод сравнения, но и как индикаторный электрод, потенциал которого находится в прямой зависимости от присутствия Н+-ионов в растворе. Приготовление водородного электрода представляет значительные трудности. Нелегко добиться, чтобы давление газообразного водорода при насыщении платины равнялось точно 101,325 кПа. Кроме того, газообразный водород должен поступать для насыщения со строго постоянной скоростью, к тому же для насыщения необходимо применять совершенно чистый водород, так как уже весьма малые количества примесей, особенно H2S и H3As, «отравляют» поверхность платины и тем самым препятствуют установлению равновесия Н2↔2Н++2е-. Получение водорода высокой степени чистоты связано со значительным усложнением аппаратуры и самого процесса работы. Поэтому на практике чаще применяется более простой каломельный электрод, обладающий устойчивым и отлично воспроизводимым потенциалом. Каломельный электрод. Неудобства, связанные с практическим применением водородного электрода сравнения, привели к необходимости создания других, более удобных электродов сравнения, одним из которых является каломельный электрод. Для приготовления каломельного электрода на дно сосуда наливают тщательно очищенную ртуть. Последнюю сверху покрывают пастой, которая получается растиранием каломели Hg2Cl2 с несколькими каплями чистой ртути в присутствии раствора хлорида калия КСl. Поверх пасты наливают раствор КСl, насыщенный каломелью. Металлическая ртуть, добавляемая в пасту, предохраняет от окисления каломели до HgCl2. В ртуть погружают платиновый контакт, от которого уже идет медная проволока к клемме. Каломельный электрод схематически записывается следующим образом: Hg|Hg2Cl2, KC1. Запятая между Hg2Cl2 и КСl означает, что между этими веществами нет поверхности раздела, так как они находятся в одном растворе. Рассмотрим, как работает каломельный электрод. Каломель, растворяясь в воде, диссоциирует с образованием ионов Hg+ и Сl-:
В присутствии хлорида калия, содержащего одноименный с каломелью ион хлора, растворимость каломели снижается. Таким образом, при данной концентрации КСl и данной температуре концентрация ионов Hg+ постоянна, чем, собственно, и обеспечивается необходимая устойчивость потенциала каломельного электрода. Потенциал (εк) в каломельном электроде возникает на поверхности соприкосновения металлической ртути с раствором ее ионов и может быть выражен следующим уравнением:
Ввиду малой способности ртути переходить в раствор потенциал имеет положительный знак по отношению к потенциалу нормального водородного электрода. Каломель Hg2Cl2 трудно растворима в воде. При 298 К ее произведение растворимости
Так как ПР при постоянной температуре есть величина постоянная, увеличение концентрации иона хлора может оказать существенное влияние на концентрацию ионов ртути, а следовательно, и на потенциал каломельного электрода. Из уравнения (4.105)
Подставляя это выражение в уравнение (4.104), получим
Объединяя постоянные при данной температуре величины ε0Нg и Ж lg (ПР) в одну величину и обозначая ее через εок, получим уравнение потенциала каломельного электрода:
Таким образом, потенциал каломельного электрода в конечном итоге зависит от концентрации (активности) ионов хлора в растворе, находящемся над слоем каломели Hg2Cl2, поэтому каломельный электрод может быть отнесен к электродам второго рода. В насыщенном растворе КСl при 291 К потенциал каломельного электрода εк=0,2503 В; в случае 1 н. раствора КСl εк —0,2864 В, в 0,1 н. КСl εк=0,3380 В. В практике чаще всего применяют каломельные электроды двух типов — с однонормальным раствором КСl и с насыщенным раствором этой соли.
Пользуясь каломельным электродом, можно опытным путем определить потенциал любого электрода. Так, для определения потенциала цинкового электрода составляют гальваническую цепь из цинка, погруженного в раствор ZnSO4, и каломельного электрода
Допустим, что экспериментально определенная э.д.с. этой цепи дает величину E=1,0103 В. Потенциал каломельного электрода εк=0,2503 В. Потенциал цинкового электрода E=εк—εZn, откуда εZn=εK-Е, или eZn = 0,2503—1,0103 = —0,76 В. Заменяя в данном элементе цинковый электрод медным, можно определить потенциал меди и т. д. Таким образом можно определить потенциалы почти всех электродов. Хлорсеребряный электрод. Помимо каломельного электрода, в лабораторной практике в качестве электрода сравнения широкое распространение получил также хлорсеребряный электрод. Этот электрод представляет собой серебряную проволоку или пластинку, припаянную к медной проволоке и впаянную в стеклянную трубку. Серебро электролитически покрывают слоем хлорида серебра и помещают в раствор КСl или НС1. Потенциал хлорсеребряного электрода, так же как и каломельного, зависит от концентрации (активности) ионов хлора в растворе и выражается уравнением
где εхс — потенциал хлорсеребряного электрода; еохс — нормальный потенциал хлорсеребряного электрода. Схематически хлорсеребряный электрод записывается следующим образом:
Потенциал этого электрода возникает на границе раздела серебро-раствор хлористого серебра. При этом имеет место следующая электродная реакция:
Ввиду чрезвычайно малой растворимости AgCl потенциал хлорсеребряного электрода имеет положительный знак по отношению к нормальному водородному электроду. В 1 н. растворе КСl потенциал хлорсеребряного электрода по водородной шкале при 298 К равен 0,2381 В, а в 0,1 н. растворе εxc = 0,2900 В и т. д. По сравнению с каломельным электродом хлорсеребряный электрод имеет значительно меньший температурный коэффициент, т. е. его потенциал в меньшей степени изменяется с температурой.
Индикаторные электроды. Для определения концентрации (активности) различных ионов в растворе электрометрическим методом на практике используются гальванические элементы, составленные из двух электродов — электрода сравнения с устойчивым и хорошо известным потенциалом и индикаторного, потенциал которого зависит от концентрации (активности) определяемого иона в растворе. В качестве электродов сравнения наиболее часто применяют каломельный и хлорсеребряный электроды. Водородный электрод для этой цели в силу его громоздкости употребляют значительно реже. Гораздо чаще этот электрод используют в качестве индикаторного электрода при определении активности водородных ионов (рН) в исследуемых растворах. Остановимся на характеристике индикаторных электродов, получивших за последние годы наиболее широкое распространение в различных областях народного хозяйства.
В состав хингидрона входит одна молекула хинона и одна молекула гидрохинона С6Н4О2·С6Н4(ОН)2. При приготовлении хингидронного электрода хингидрон всегда берут в количестве, гарантирующем насыщенность им раствора, т. е. он должен оставаться частично не растворившимся в осадке. Необходимо отметить, что насыщенный раствор получается при внесении очень маленькой щепотки хингидрона, так как его растворимость в воде составляет всего около 0,005 моль на 1 л воды. Рассмотрим теорию хингидронного электрода. При растворении в воде происходят следующие процессы: хингидрон распадается на хинон и гидрохинон:
Гидрохинон, являясь слабой кислотой, в незначительной степени диссоциирует на ионы по уравнению
В свою очередь образовавшийся ион хинона может окисляться в хинон при условии отвода электронов:
Суммарная реакция, протекающая на катоде,
Константа равновесия этой реакции
Благодаря тому, что в растворе, насыщенном хингидроном, концентрации хинона и гидрохинона равны, концентрация водородного иона постоянна. Хингидронный электрод можно рассматривать как водородный при очень малом давлении водорода (приблизительно 10-25 МПа). Предполагают, что в этом случае вблизи электрода протекает реакция
Образующийся газообразный водород насыщает под таким давлением платиновую проволоку или пластинку, опущенную в раствор. Электроны, образующиеся согласно реакции (г), переходят на платину, в силу чего возникает разность потенциалов между платиной и прилегающим раствором. Таким образом, потенциал данной системы зависит от соотношения концентраций окисленной и восстановленной форм и от концентрации ионов водорода в растворе. С учетом этого уравнение электродного потенциала хингидронного электрода имеет вид
где ε0хг — стандартный потенциал хингидронного электрода. Так как в насыщенном растворе хингидрона отношение [С6Н4О2]/ [С6Н4(ОН)2]=1, то уравнение (4.110) примет вид:
Из формулы (4.111) видно, что потенциал хингидронного электрода находится в прямой зависимости от концентрации (точнее, от активности) водородных ионов в растворе. В результате практических измерений было установлено, что нормальный потенциал хингидронного электрода (ан+ =1) равен 0,7044 В при 291 К. Поэтому, подставляя в уравнение (4.111) вместо ε0хг и Ж их численные значения, получим окончательное уравнение потенциала хингидронного электрода:
Таким образом, потенциал хингидронного электрода, так же как и водородного, зависит при данной температуре только от концентрации (активности) водородных ионов в растворе.
 Стеклянный электрод. Этот электрод в настоящее время получил самое широкое распространение. Для изготовления стеклянного электрода применяют стекло определенного химического состава. Одной из наиболее часто употребляющихся форм стеклянного электрода является стеклянная трубка, заканчивающаяся тонкостенным шариком. Шарик заполняют раствором НСl с определенной концентрацией ионов Н+, в который погружен вспомогательный электрод (например, хлорсеребряный). Иногда, стеклянные электроды изготовляют в виде тонкостенной мембраны из стекла, обладающего водородной функцией. Мембрана припаивается к концу стеклянной трубки (рис. 4.17). Стеклянный электрод отличается от уже рассмотренных электродов тем, что в соответствующей ему электродной реакции не участвуют электроны. Наружная поверхность стеклянной мембраны служит источником водородных ионов и обменивается ими с раствором подобно водородному электроду. Иными словами, электродная реакция сводится здесь к обмену ионами водорода между двумя фазами — раствором и стеклом: Н+= Н+ст. Поскольку заряд водородного иона соответствует элементарному положительному количеству электричества и переход иона водорода из одной фазы в другую эквивалентен перемещению единичного заряда (n = 1), потенциал стеклянного электрода (εст) может быть выражен следующим уравнением: Стеклянный электрод. Этот электрод в настоящее время получил самое широкое распространение. Для изготовления стеклянного электрода применяют стекло определенного химического состава. Одной из наиболее часто употребляющихся форм стеклянного электрода является стеклянная трубка, заканчивающаяся тонкостенным шариком. Шарик заполняют раствором НСl с определенной концентрацией ионов Н+, в который погружен вспомогательный электрод (например, хлорсеребряный). Иногда, стеклянные электроды изготовляют в виде тонкостенной мембраны из стекла, обладающего водородной функцией. Мембрана припаивается к концу стеклянной трубки (рис. 4.17). Стеклянный электрод отличается от уже рассмотренных электродов тем, что в соответствующей ему электродной реакции не участвуют электроны. Наружная поверхность стеклянной мембраны служит источником водородных ионов и обменивается ими с раствором подобно водородному электроду. Иными словами, электродная реакция сводится здесь к обмену ионами водорода между двумя фазами — раствором и стеклом: Н+= Н+ст. Поскольку заряд водородного иона соответствует элементарному положительному количеству электричества и переход иона водорода из одной фазы в другую эквивалентен перемещению единичного заряда (n = 1), потенциал стеклянного электрода (εст) может быть выражен следующим уравнением:
где ε0ст — стандартный потенциал стеклянного электрода. Как показали исследования, в реакцию обмена, помимо ионов водорода, вовлекаются также входящие в состав стекла ионы щелочного металла. При этом они частично заменяются на ионы водорода, а сами переходят в раствор. Между поверхностным слоем стекла и раствором устанавливается равновесие ионообменного процесса:
где М+ в зависимости от сорта стекла могут быть ионами лития, натрия или другого щелочного металла. Условие равновесия этой реакции выражается законом действующих масс:
Размер этой константы обмена зависит от свойств стекла, из которого изготовлен электрод, а также от температуры. Для исследованных до настоящего времени стекол значение К колеблется от 10 до 10-13. Исходя из предположения, что в стекле данного сорта сумма активностей ионов водорода и ионов щелочного металла постоянна, т. е.
уравнение константы обмена можно переписать в следующем виде:
Решая это уравнение относительно
Замена ан+ /ан ст+ в уравнении электродного потенциала стекла (4.113) его значением из уравнения (4.117) приводит к следующему выражению:
где постоянная Ж 1ga включена в стандартный потенциал стеклянного электрода ε0ст. Таким образом, в общем случае потенциал любого стеклянного электрода обусловливается двумя величинами: активностью ионов водорода и активностью щелочного металла. Если в растворе ан+>>Кобмам+, то
т. е. электрод обладает водородной функцией и потому может служить индикаторным электродом при определении рН. Если в растворе ан+<<Кобмам+, то
т.е.электрод обладает металлической функцией. В этом уравнении в величину ε0м входит слагаемое, содержащее константу обмена, т. е.
Стеклянный электрод с металлической функцией может использоваться в качестве индикаторного электрода для определения активности ионов соответствующего щелочного металла. Таким образом, в зависимости от сорта стекла (точнее, от размера константы обмена) стеклянный электрод может обладать водородной и металлической функцией. Изложенные представления о стеклянном электроде лежат в основе термодинамической теории стеклянного электрода, разработанной Б. П. Никольским (1937) и основанной на представлении о существовании обмена ионами между стеклом и раствором. Схематически стеклянный электрод с водородной функцией можно записать так:
В качестве внутреннего электрода здесь взят хлорсеребряный электрод. Ввиду того, что в уравнении стеклянного электрода (4.121) величина Ж на практике получается несколько меньше теоретической и ε0ст зависит от сорта стекла и даже от способа приготовления электрода (т. е. является неустойчивой величиной), стеклянный электрод (так же как и сурьмяный) перед определением рН исследуемого раствора предварительно калибруют по стандартным буферным растворам, рН которых точно известен. Преимущество стеклянного электрода перед водородным и хингидронным электродами заключается в том, что он позволяет определять рН раствора любого химического соединения в достаточно широком диапазоне значений.
|
|


 Диффузионные потенциалы могут возникать и в биологических объектах при повреждении, например, оболочек клеток. При этом нарушается избирательность их проницаемости и электролиты начинают диффундировать в клетку или из нее — в зависимости от разности концентраций. В результате диффузии электролитов возникает так называемый потенциал повреждения, который может достигать величин порядка 30—40 милливольт. Причем поврежденная ткань заряжается отрицательно по отношению к неповрежденной.
Диффузионные потенциалы могут возникать и в биологических объектах при повреждении, например, оболочек клеток. При этом нарушается избирательность их проницаемости и электролиты начинают диффундировать в клетку или из нее — в зависимости от разности концентраций. В результате диффузии электролитов возникает так называемый потенциал повреждения, который может достигать величин порядка 30—40 милливольт. Причем поврежденная ткань заряжается отрицательно по отношению к неповрежденной.




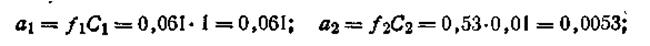
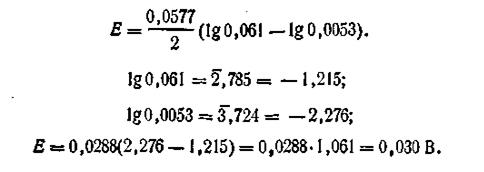




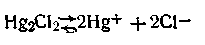











 Хингидронный электрод. Одним из широко распространенных в практике электродов, потенциал которых зависит от активности водородных ионов в растворе, является так называемый хингидронный электрод (рис. 4.16). Этот электрод весьма выгодно отличается от водородного электрода своей простотой и удобством в работе. Он предоставляет собой платиновую проволоку 1, опущенную в сосуд с исследуемым раствором 2, в котором предварительно растворяют избыточное количество порошка хингидрона 3. Хингидрон представляет собой эквимолекулярное соединение двух органических соединений — хинона С6Н4О2 и гидрохинона СбН4(ОН)2, кристаллизующихся в виде мелких темно-зеленых с металлическим блеском игл. Хинон является дикетоном, а гидрохинон— двухатомным спиртом.
Хингидронный электрод. Одним из широко распространенных в практике электродов, потенциал которых зависит от активности водородных ионов в растворе, является так называемый хингидронный электрод (рис. 4.16). Этот электрод весьма выгодно отличается от водородного электрода своей простотой и удобством в работе. Он предоставляет собой платиновую проволоку 1, опущенную в сосуд с исследуемым раствором 2, в котором предварительно растворяют избыточное количество порошка хингидрона 3. Хингидрон представляет собой эквимолекулярное соединение двух органических соединений — хинона С6Н4О2 и гидрохинона СбН4(ОН)2, кристаллизующихся в виде мелких темно-зеленых с металлическим блеском игл. Хинон является дикетоном, а гидрохинон— двухатомным спиртом.












 , получим
, получим




