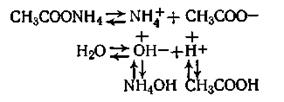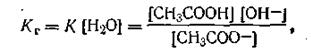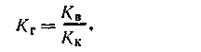|
|
Реакция среды в растворах солей, гидролиз.Опыт показывает, что реакция водного раствора зависит не только от наличия в нем кислот или оснований, но также и от присутствия некоторых солей. Многие соли, растворяясь в воде, способны смещать реакцию среды в ту или иную сторону. При этом происходит химическое взаимодействие между ионами соли и ионами Н+ и ОН- воды, сопровождающееся образованием слабых кислот или слабых оснований. Эта реакция получила название гидролиза соли. Гидролиз соли — это процесс взаимодействия ее ионов с ионами воды. В результате гидролиза растворы большинства солей имеют кислую или щелочную реакцию. В качестве иллюстрации приведем три наиболее типичных случая реакции гидролиза солей. 1. Соль, образованная сильным основанием и слабой кислотой. В водном растворе гидролизуется с образованием слабой кислоты и сильного основания; реакция среды щелочная. Пример: гидролиз ацетата натрия, протекающий по схеме
В данном случае гидролиз ведет к увеличению концентрации ионов ОН- в растворе. Например, рН 0,1 н. раствора ацетата натрия равен 9,9. 2. Соль, образованная слабым основанием и сильной кислотой. Пример: хлорид аммония NH4C1. При его гидролизе равновесие между недиссоциированными молекулами воды и ионами (Н2О↔Н++ОН-) нарушается: образуется слабое основание и избыток ионов водорода. Гидролиз хлорида аммония протекает по схеме
Связываясь с гидроксид-ионами воды, ионы NH4+ образуют слабодиссоциирующий гидроксид аммония, в растворе появляется избыток ионов водорода, в результате чего реакция смещается в кислую сторону. Так, рН 0,1 н. раствора NH4C1 равен 5,3. 3. Соль, образованная слабой кислотой и слабым основанием. Пример: ацетат аммония CH3 COONH4, диссоциирующий на ионы NH4+ и СН3СОО-. В данном случае с ионами Н+ и ОН- воды реагируют и катионы и анионы соли по схеме
В результате гидролиза ацетата аммония происходит образование двух слабых электролитов: гидроксида аммония и уксусной кислоты.
Так как значения константы диссоциации уксусной кислоты и гидроксида аммония очень близки:Ксн3соон= 1,75·10-5 и КNH40H = 1,79·10-5 (при 298 К), то и образующиеся в результате гидролиза кислота и основание практически равны по силе. Раствор такой соли оказывается нейтральным. Так, например, рН 0,01 н. раствора CH3COONH4 равен 7. В заключение отметим, что соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. Их ионы не образуют с ионами Н+ и ОН- воды слабодиссоциирующих или труднорастворимых соединений, равновесие между недиссоциированными молекулами и ионами воды не нарушается и раствор остается нейтральным (рН практически равен 7). К этой группе относятся соли NaCl, KC1, NaNO3, BaCl2 и др. Как уже отмечалось, рН солей третьей группы в водных растворах также близко к 7. Однако они резко отличаются от солей, образованных сильным основанием и сильной кислотой. Последние гидролизу не подвергаются и потому рН раствора не меняют. Соли третьей группы сильно гидролизуются, образуя в водных растворах определенные и очень устойчивые рН, близкие к 7. Рассмотрим, чему равняется рН гидролитически щелочных или гидролитически кислых солей. В качестве примера возьмем гидролиз ацетата натрия:
Ионное уравнение гидролиза этой соли будет иметь вид
Следует принять во внимание, что соль и основание как сильные электролиты полностью диссоциированы, а слабая кислота практически недиссоциирована. Применяя закон действующих масс к данной равновесной реакции, получим
Поскольку концентрация воды практически остается постоянной, ее можно объединить с константой равновесия, т. е.
где Кг — константа гидролиза, равная К[Н2О]. Из уравнения диссоциации слабой уксусной кислоты СНзСООН↔СН3СОО- + Н+ на основании закона действующих масс можем записать:
Подставляя это выражение в уравнение (4.65), получим
Произведя сокращения и учитывая, что [Н+][ОН-] = Кв, уравнение (4.67) примет следующий вид:
Таким образом, константа гидролиза гидролитически щелочной соли равна отношению ионного произведения воды к константе диссоциации слабой кислоты, образованной в результате реакции гидролиза. С учетом этого уравнение (4.68) можно представить в таком виде:
Поскольку при гидролизе ацетата натрия образуется равное количество молекул уксусной кислоты и ионов ОН-, т. е. [СН3СООН] =[ОН-], уравнение (4.69) можно переписать так:
Так как по сравнению с общей концентрацией С соли ацетата натрия гидролизу подвергается лишь незначительная часть анионов СН3СОО-, без большой погрешности можно принять, что в растворе [СН3СО-] = С, где С — аналитическая концентрация CH3COONa, Тогда уравнение (4.70) примет следующее выражение:
Из уравнения ионного произведения воды можем записать:
Подставляем это выражение в уравнение (4.71):
Логарифмируя это выражение и меняя знаки, получим окончательное уравнение для вычисления рН гидролитически щелочной соли:
или, учитывая, что при 295 К КВ= 10-14 и —lgКК = pК, узнаем
Пример.Вычислить рН 0,1 н. раствора CH3COONa.Для решения пользуемся формулой (4,73). Константа диссоциации уксусной кислоты КК= 1,86·10-5, а концентрация С=0,1 н. Подставляя эти данные в формулу, получим рН= 7+1/2(—lg 1,85·10-5)+1/2 lg 0,1 = 7+2,36—0,5 = 8,86. Совершенно аналогичный вывод формулы для вычисления рН можно сделать и для гидролитически кислой соли. Формула будет такая же, только знаки поменяются на обратные:
где рК — отрицательный логарифм константы диссоциации слабого основания, С—концентрация гидролитически кислой соли.
|
|