|
|
Электродный потенциал. Уравнение Нернста.Учение об электродвижущих силах гальванических элементов является одним из основных разделов электрохимии. Начало изучению электродвижущих сил было положено еще М. В. Ломоносовым (1750), который в своих работах отмечал связь между химическими и электрическими явлениями. Позднее наблюдения итальянского физиолога Гальвани (1780) и обширные работы итальянского физика Вольта (1780) привели к открытию гальванических элементов. В 1800 г. Вольта изобрел первый химический источник тока, так называемый вольтов столб, который был собран из пластинок различных металлов, разделенных прослойками ткани, смоченной электролитом. Исследования привели Вольта к открытию контактной разности потенциалов, возникающей при соприкосновении металлов различной природы. В первых исследованиях в качестве чувствительного прибора для обнаружения малой разности потенциалов ученый использовал свежеанатомированные мышцы лягушки. Этот случай является наглядным примером того, как биологические методы исследования нередко могут способствовать успешному развитию физики и других точных наук. Открытие химических источников тока и контактной разности потенциалов оказало большое влияние на все последующее развитие электрохимических явлений. В настоящее время методы электрохимии получили широкое распространение в агрохимии, физиологии растений, в биологии, почвоведении, а также во многих других смежных дисциплинах. Если в чистую воду погрузить пластинку какого-либо металла, то согласно гидратной теории Д. И. Менделеева ионы металла будут взаимодействовать с полярными молекулами воды. Иными словами, поверхностно расположенные катионы этого металла будут гидратироваться молекулами воды и переходить в окружающий раствор, заряжая его положительно, т. е. металл будет как бы растворяться (рис.4.8). Однако электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. В результате этого между ионами металла, перешедшими в раствор, и поверхностью металлической пластинки возникают силы электростатического притяжения, в силу чего ионы, окружающие пластинку, образуют так называемый двойной электрический слой, схема которого приведена на рис. 4.8. Этот слой препятствует дальнейшему растворению металла и в системе устанавливается подвижное равновесие, которое характеризуется равными скоростями как растворения, так и обратного осаждения ионов из раствора на поверхности металлической пластинки. Первоначально считали, что двойной электрический слой имеет плоское строение. Он уподоблялся конденсатору, одна из обкладок которого расположена на поверхности металла, другая — в слое прилегающей к электроду жидкости. Расстояние между обкладками равно диаметру молекулы. Согласно этой теории, которую обычно связывают с именем Гельмгольца (1879), учитывалось только проявление электростатических сил взаимодействия между зарядами противоположного знака и не учитывалось изменение свойств двойного электрического слоя с изменением концентрации электролита и его температуры, что явилось основным недостатком теории Гельмгольца. В разработке современной теории строения двойного электрического слоя на границе твердая фаза—жидкость и методов его исследования ведущая роль принадлежит А. Н. Фрумкину и его школе. Работы А. Н. Фрумкина и его учеников установили, что слой ионов, располагающийся в жидкости, благодаря действию двух противоположно направленных сил (электростатического притяжения и теплового движения) имеет диффузное строение, т. е. он проникает в жидкость на некоторую глубину (рис. 4.8).

Определенная часть ионов удерживается вблизи поверхности раздела металл—электролит, образуя обкладку двойного слоя с толщиной, отвечающей среднему радиусу ионов электролита. Остальные ионы, входящие в состав двойного слоя, распределяются диффузно, с постепенно убывающей плотностью заряда. Таким образом, при соприкосновении металла с водой ионы его находятся под действием двух конкурирующих сил: электростатического притяжения, возникающего между ионами металла и молекулами воды (явление гидратации), и электростатического притяжения со стороны электронного газа, определяющего прочность кристаллической решетки. Вполне понятно, что чем прочнее кристаллическая решетка металла, тем труднее иону металла перейти в раствор. Чем выше величина энергии гидратации, тем с большей жадностью молекулы воды взаимодействуют с этими ионами, и тем легче им выделиться в раствор. В результате взаимодействия двух указанных взаимно противоположных сил растворение металла в воде приобретает характер только поверхностного процесса и охватывает лишь очень узкую область на границе металл—жидкость. В этом поверхностном слое концентрация ионов металла, несмотря на его чрезвычайно малую растворимость, может быть довольно значительной. Кроме того, в поверхностном растворе гидратированные катионы в силу электростатических сил притяжения со стороны электронов кристаллической решетки металла совершают лишь ограниченное кинетическое движение в виде так называемых «пристенных» скачков. Они прочно связаны с жестким каркасом кристаллической решетки металла. Таким образом, в системе металл — вода на границе раздела фаз возникает двойной электрический слой, блокирующий поверхность металла. Образовавшаяся пограничная разность потенциалов получила название электродного потенциала (дат. potentia — возможность, мощь). Если жидкая среда — чистая вода, для всех металлов картина в качественном отношении будет однозначной: металл заряжается отрицательно, прилегающий слой жидкости — положительно. Однако количественно для разных металлов будут наблюдаться существенные различия, что объясняется не только неодинаковой энергией связи катионов этих металлов в кристаллической решетке, но и неодинаковой гидратируемостью этих катионов. Несколько иная картина наблюдается в случае, если металлическую пластинку погрузить не в чистую воду, а в раствор соли этого металла. При этом могут иметь место три случая. 1. Исходная концентрация ионов данного металла в растворе С меньше концентрации Со, соответствующей равновесному состоянию ионов после погружения в раствор металлической пластинки, т. е. С<С0. При этом будут происходить оба процесса — переход металла в раствор
и выделение металла из раствора -
Поскольку С<Со, преобладающим будет процесс (а), т. е. выделение электронов превысит их поглощение. В результате этого поверхность металлической пластинки зарядится отрицательно, а прилегающий слой раствора — положительно. 2. Концентрация ионов металла С больше равновесной концентрации С0, т. е. С>С0. В этом случае наблюдается обратное явление: ионы металла из раствора выделяются на поверхности металлической пластинки. Чтобы ионы металла могли выделиться, они должны присоединить электроны согласно уравнению (б). Поскольку источника электронов в системе нет, выделение металла на поверхности пластинки происходит в виде ионов. В результате поверхность приобретает положительный заряд. 3. При условии С=С0 вся система будет находиться в состоянии подвижного равновесия, разность потенциалов между жидкостью и металлом равна нулю. В этом случае из раствора осаждается на единицу поверхности металла столько же катионов, сколько их выходит в двойной электрический слой. Принимая это во внимание, нетрудно найти математическую зависимость между величиной скачка потенциала на границе соприкосновения металла и раствора и концентрацией (точнее, активностью) ионов этого металла в растворе.
Так как активность металла принимается равной единице (аMе= 1), то с учетом этого уравнения (4.84) будет иметь следующее выражение:
Уравнение (4.85) называется уравнением Нернста, ε0— постоянная величина, характеризующая электрохимическую природу электрода. Для расчетов удобнее предварительно вычислить значение R·T· 2,303/F при какой-либо температуре. Например, при 291 К это число будет равно 0,0577. Следовательно, для температуры 291 К уравнение Нернста будет иметь вид:
Обозначим численное значение выражения R·T·2,303/F буквой Ж. Зависимость этого числа от температуры выразится следующей формулой:
где Г —любая температура, при которой производится измерение разности потенциалов. С учетом этого обозначения уравнение электродного потенциала Нернста будет иметь следующий вид:
обращается в нуль, и тогда
Таким образом, стандартным (нормальным) потенциалом называется такой потенциал, который возникает на металлической пластинке, находящейся в контакте с одноименными ионами в растворе, с концентрацией С=1 моль/л. За нулевую точку измерения потенциалов условно принят нормальный потенциал водородного электрода. Для изготовления его используют способность платины растворять газообразный водород. Платиновая проволока или пластинка, содержащая растворенный водород, играет роль «водородной пластинки», а функции «раствора солей» может выполнять любой водный раствор, в котором всегда присутствуют ионы водорода Н+. Причем нормальный потенциал водородного электрода равен нулю при условии, что давление молекулярного водорода на пластинке равно 101,325 кПа и СН+ = 1 моль/л. Если нормальный потенциал какого-либо металла больше водородного, его принято считать положительным, если меньше — отрицательном. Если все металлы расположить последовательно по возрастающей величине их нормальных электродных потенциалов, получится ряд напряжений. В табл. 4.9 приведены стандартные потенциалы некоторых металлов. В этой таблице каждый электрод обозначен символом элемента, из которого он состоит, и соответствующего иона, а вертикальная линейка изображает поверхность раздела двух фаз, где имеет место скачок потенциала. Представленным в табл. 4.9 рядом напряжений широко пользуются в практике при составлении так называемых гальванических элементов, а также при изучении взаимодействия между металлами и кислотами, между солями и металлами. Зная ряд напряжений, можно предвидеть направление реакции вытеснения одних элементов другими. Так металлы, стоящие в ряду напряжений после водорода, не способны вытеснять водород из кислот. Вытеснение металла из солей другим металлом осуществляется только в том случае, если вытесняющий металл расположен в ряду напряжений до вытесняемого. Например, при составлении гальванического элемента из цинка и свинца в качестве положительного электрода следует взять свинцовый (εо= -0,13 В), а в качестве отрицательного — цинковый (εо= -0,76 В).

Электроды подразделяются на электроды первого и второго рода. Электроды первого рода — это электроды из металла, погруженного в раствор, содержащий ионы того же металла (например, Cu|Cu2+, Zn|Zn2+). Эти электроды обратимо обменивают катионы Ме↔Меn+nе, где n — число теряемых (или приобретаемых) электронов (е-). Электроды второго рода состоят из металла, покрытого слоем труднорастворимой соли и погруженного в раствор какой-либо легкорастворимой соли с тем же анионом. Такие электроды обратимы относительно этого аниона. Для электродов второго рода выражение электродного потенциала |
|
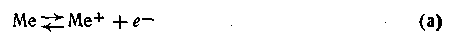

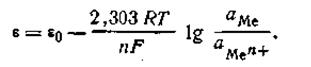
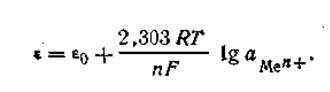
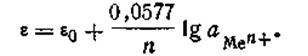
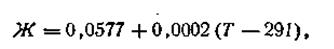
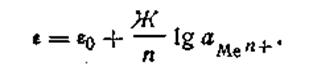
 Каков же физический смысл εо в уравнении электродного потенциала Нернста? Несложный математический анализ этого уравнения показывает, что при С=1 моль/л все выражение
Каков же физический смысл εо в уравнении электродного потенциала Нернста? Несложный математический анализ этого уравнения показывает, что при С=1 моль/л все выражение