|
|
Электролитпен коагуляциялау кинетикасы 7 главаОсы себептерге байланысты сұйықтың булануы конденсациямен салыстырғанда қысымның біршама аз мәнінде жүреді, адсорбция - десорбция изотермаларында капиллярлық гистерезис түйіні пайда болады.
6. Кеуек адсорбенттердің негізгі адсорбциялық параметрлерін анықтау
Кеуек денелердің адсорбциялық параметрлерін анықтау үшін алдымен адсорбция изотермасын a (моль/кг) = f (p/ps) графигі түрінде тұрғызады. Сонан соң дененің кеуектігін (дененің бірлік массасына сәйкес келетін кеуектер көлемін) мына теңдеу арқылы есептейді: V (м3/кг) = a×um . (6.1)
Мұндағы um – адсорбаттың (газдың) мольдік көлемі, м3/моль. Дененің бойындағы әртүрлі кеуектердің өлшеміне сәйкес келетін конденсациялану қысымының (р/рs) мәнін Томсон (Кельвин) теңдеуіне қойып, қуыс денедегі шар тәріздес менискілердің тиімді радиустарын есептейді:
(6.2)
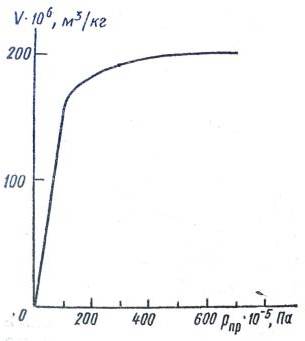
Ары қарай адсорбент кеуектерінің радиустары бойынша таралуының интегралдық (V = f (r))тәуелдігі) және дифференциалдық (DV/Dr = f (r) тәуелдігі)қисықтарын тұрғызады (6.1-сурет).
6.1-сурет. Активтелген көмір кеуектерінің радиустары бойынша таралуының интегралдық (1) және дифференциалдық (2) қисықтары
7. Кеуек дененің меншікті бетінің ауданын анықтау
Кеуек дененің меншікті бетінің ауданын анықтау А.В.Киселев ұсынған капиллярлық конденсацияның термодинамикалық теңдеуіне негізделген:
(7.1)
Мұндағы S – қатты дене бетінің ауданы; ps- жазық бет үстіндегі газдың (будың) қаныққан бу қысымы; p –тәжірибе жүргізілген жағдайдағы будың тепе-теңдік күйге сәйкес келетін қысымы; R-универсал газ тұрақтысы; T-абсолюттік температура; a-меншікті адсорбция, моль/кг; s- конденсаттың беттік керілуі. Соңғы теңдеуді капиллярлық конденсацияның барлық интервалы бойынша, яғни конденсацияның басталуына сәйкес келетін Sk ауданынан бастап, кеуектер толығымен толтырылған жағдайға сәйкес келетін S¥ ауданға дейін, интегралдасақ мынадай теңдеу аламыз:
. (7.2)
Мұндағы ak мен a¥ - капиллярлық конденсацияның басталуына және аяқталуына сәйкес келетін адсорбцияның меншікті мәндері. Sk >> S¥ болғанда ( кеуектер толығымен толтырылғанда беттің ауданы күрт азаяды) S¥ шамасын ескермеуге болады. Олай болса соңғы теңдеуден мына теңдеу туындайды:
(7.3)
Sk мәнін графикалық жолмен анықтайды. Ол сан жағынан ln (ps/p) = f (a, моль/кг) тәуелдігі қисығындағы akмен a¥ кординаталарымен және изотерманың десорбциялық қисығымен шектелген беттің ауданына тең (7.1-сурет).
7.9-сурет. Капиллярлық конденсация аймағындағы газдың салыстырмалы қысымы мен адсорбциясы арасындағы байланыс
Sk мен адсорбенттің меншікті бетінің ауданы (Sмен) мәндері өзара жуық, өйткені конденсация басталған кезде адсорбциялық қабат өте жұқа болады.
8. Кеуек өлшеу әдісімен адсорбенттің кеуектігін және кеуектерінің радиустары бойынша таралуын анықтау
Бұл әдіс сынаптың қатты денелердің көбісінің бетіне жұқпайтындығына негізделген. Сынаптық кеуек өлшеу әдісінде кеуек дененің бойына гидравликалық қысым түсіру арқылы сынапты енгізеді. Сонан соң дененің бойына енгізілген сынап көлемі мен түсірілген гидравликалық қысым арасындағы байланысты анықтайды. Дене бойындағы кеуектерді сынаппен толтыру үшін капиллярлық қысымға қарсы жұмыс атқару керек, яғни капиллярлық қысымнан артық қысым түсіру қажет. Адсорбент бойындағы кеуектерді сынаппен толтыру құбылысын Жюрен теңдеуімен сипаттайды:
R h g r = - 2 s cos q . (8.1)
МұндағыR- қатты дене бойындағы кеуектер радиусы; h-сынаптың капилляр бойымен төмен түсу тереңдігі; g-еркін түсу үдеуі; r-сынаптың тығыздығы; s-сынаптың беттік керілуі; q-сынаптың қатты дене бетіне жұғу бұрышы. Ал қатты дене бойына сынапты енгізу үшін түсірілетін қысым мен сынаптың тығыздығы арасында мынадай байланыс бар: h g r = р. (8.2)
Олай болса (8.1) теңдеуді қысым арқылы басқаша өрнектеуге болады: R = - 2 s cos q / р . (8.3)
Практикада сынаптық кеуек өлшегіш көмегімен әртүрлі қысым түсіре отырып, қатты дене бойына сынапты енгізеді де, дененің бойына енген сынап көлемінің (V) түсірілген гидравликалық (р), немесе келтірілген (ркел) қысымға тәуелдігін өрнектейтін қисықты (порограмма) тұрғызады (8.1-сурет).
8.1-сурет.Активтелген көмірдің порограммасы
Порограмма негізінде дененің бойындағы кеуектер көлемінің радиустары бойынша таралуын сипаттайтын интегралдық (V = f (r))графигін) және дифференциалдық (DV/Dr = f (r)) графигін)қисықтарын тұрғызады (8.2-сурет). Кеуек өлшеу әдісінің интегралдық қисығы кеуек адсорбент бойындағы кеуектердің радиустары бойынша таралуын, яғни кеуектердің өлшемдері бойынша пайыздық мөлшерін көрсетеді.
8.2-сурет. Порограмма негізінде есептелген активтелген көмірдің кеуек көлемінің радиустары бойынша таралуының интегралдық (1) және дифференциалдық (2) қисықтары 9. Адсорбцияның энергетикалық параметрлері Гиббстің фундаменталдық теңдеуін пайдаланып газдың қатты дене бетіндегі адсорбциясын қарастырайық. Қатты зат бу конденсатында ерімейтін болсын. Осындай жағдайда жүйенің Гиббс энергиясының өзгерісі мынадай болады: ∆Gs=∆σ+Г2∆µ2 µ2-адсорбцияланған газдың химиялық потенциалы Гиббстің фундаменталдық теңдеуі (тек адсорбцияланатын газдың параметрлерін еске алады) мынадай болады: -d∆σ= Г2d∆µ2; -∆σ=∫ Г2d∆µ2 (54) Осыны жоғары теңдеуге қойсақ:
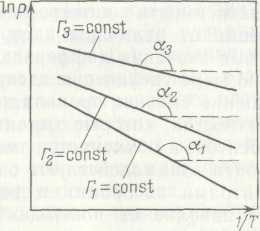
∆Gs= Г2∆µ2-∫ Г2d∆µ2 Бұл теңдеуді математикада қолданылатын бөлшектеп интегралдау (по частям) формуласымен салыстырып мынаны жазуға болады: ∆Gs=∫ ∆µ2 Г2 (55) Сонымен, гиббстік адсорбцияның адсорбаттың химиялық потенциалына тәуелділігін біле отырып, адсорбция кезіндегі Гиббс энергиясының интегралдық өзгеруін есептеуге болады. Теріс таңбамен алынған осы шаманы адсорбцияның интегралдық жұмысы деп атайды. Wадс=-∆Gs (56) Адсорбция кезінде Гиббс энергиясының дифференциалдық өзгеруін (55) – теңдеуді гиббстік адсорбция Г2 бойынша дифференциалдап алуға болады: ∆Gd=∂∆Gs/∂Г2=∆µ2 (57) (57) – теңдеуден адсорбция кезінде Гиббс энергиясының дифференциялдық өзгерісі адсорбаттың 1 мольінің стандарттық күйден (сұйықтық, қаныққан бу) адсорбенттің бетіне көшкендегі химиялық потенциалының өзгерісіне тең екен. Адсорбция кезінде Гиббс энергиясының дифференциалдық өзгерісіне тең шаманың теріс таңбамен алынған мөлшерін адсорбцияның дифференциалдық жұмысы немесе адсорбциялық потенциал деп аталады. ε=-∆µ2=RTln(Ps/P) (58) мұндағы: P – адсорбция жүйедегі бу қысымы, Ps – сұйықтық бетіндегі қаныққан бу қысымы. Адсорбция (концентрация) қысымның артуына байланысты өсетіндіктен (58) – теңдеуден адсорбцияның дифференциалдық жұмысы адсорбат концентрациясына байланысты азаяды, адсорбцияға байланысты да азаяды. Энтропияның дифференциалдық өзгеруін ∆Gd – ны температура бойынша дифферециалдап алуға болады: ∆S=-∂∆Gd/∂T=-(∂∆µ2/∂T)Г2=-Rln(P/Ps)-RT(∂lnP/∂T)Г2+RT(∂Ps/∂T) (59) Ал энтальпияның дифференциалдық өзгеруін ∆Hd=∆Gd+T∆Sd теңдеуіне (58) және (59) – теңдеулерден оларға сәйкес өрнектерді қойып алуға болады: ∆Hd=RT2(∂lnP/∂σ)Г2- RT2(∂lnPs/∂T) (60) (59) және (60) – теңдеулерден энтропия және энтальпияның дифференциалдық өзгерісін есептеу үшін бу қысымының температура бойынша тәуелділігін адсорбцияның тұрақты шамасында (изостера) білу керек. Бұл тәуелділіктерден адсорбент бетінің берілген толтырылуындағы (адсорбция шамасындағы) бу қысымы үшін температуралық коэффициентінің қажетті мәнін алуға болады. (60) – теңдеудегі бірінші мүше адсорбцияның дифференциалдық жылуын өрнектейді: qd=RT2(∂lnP/∂T)Г2 (61) ал теңдеудің екінші мүшесі будың көлемдік конденсациясының жылуынкөрсетеді: L=RT2dlnPs/dT (62) Адсорбцияның энтальпиясына тең таңбасы кері болатын шама адсорбцияның таза жылуы деп аталады. λd=qd-L (63) Адсорбцияның энергиясын және дифференциалдық жылуын анықтау үшін lnP-1/T координаттары бойынша график тұрғызады.
3- график
qd температураға тәуелсіз жағдайда адсорбцияның дифференциалдық жылуы үшін: (lnP)Г2=-qd/R·l/T+const (64) Адсорбцияның дифференциалдық жылуы қисаю бұрышының тангенсімен анықталады: tgα = -qd/R Адсорбент бетінің әртүрлі толтырылуында изостераны құру адсорбцияның дифференциалдық жылуының өзгеруін көрсетеді, оны изостералық өзгеру деп атайды. Беттің толтырылуына байланысты адсорбцияның изостералық жылуы азаяды, яғни жылу жүйеден шығады. Бұл жылудың мөлшері заттың бірлік массасына есептеледі (Дж/моль). Адсорбцияның дифференциалдық жылуын интегралдап адсорбцияның интегралдық жылуын алуға болады: Qs=∫qd·dГ2 (65) Ол беттің берілген толтырылуындағы адсорбция жылуын анықтайды және (65) – ге сәйкес адсорбенттін бірлік ауданына (немесе массасына) келетін жылудың бірліктерімен өлшенеді. 2.9. Қатты дене - ерітінді жанасу бетіндегі адсорбция Қатты дене мен ерітінді арасындағы адсорбцияның лизольдердің түзілуі мен бұзылуының және тұрақтылығының негізін түсіндіретін болғандықтан коллоидтық химия үшін маңызы зор. Енді адсорбцияның осы түріне тоқталайық. Қатты дене мен ерітінді арасындағы адсорбция қатты дене мен газ арасындағы адсорбцияға жалпы алғанда ұқсас. Алайда қарастырып отырған адсорбцияның өзіне тән қиындықтары бар. Соның нәтижесінде осы уақытқа дейін қатты дене мен ерітінді арасындағы адсорбцияның жалпы теориясы жоқ. Бұл адсорбцияны түсіндіру үшін кейде бұның газ бен қатты дене арасындағы адсорбциясына ұқсастығын пайдаланып (дұрысырақ айтқанда газ бен ерітіндідегі еріген заттың ұқсастығын пайдаланып) Лэнгмюр, Фрейндлих теңдеулерін қолдануға болады. Жалпы қатты денедегі адсорбцияның қиындығына (қатты дене бетінің күйі және оны сандық өлшеудің қиындығы) қоса ерітіндінің қатты денедегі адсорбцияның тағы қосымша қиындықтары болады. Олар біріншіден, қатты дене де еріген заттың ғана адсорбциясы емес, оған қоса еріткіштің адсорбциясы қосарлана жүруінен, яғни бәсекелік адсорбция болады. Екіншіден, адсорбтивтің молекулалары мен еріткіштің молекулалары арасындағы әрекеттесудің болуынан. Ал егер еріткіштегі еріген зат электролит болатын болса, онда адсорбция иондық болады, оны да еске алу керек. Міне осы айтылған ерекшеліктерге сүйене отырып қатты дене мен ерітінді арасындағы адсорбцияны біз оны жалпы сапалы түрде қарастырумен шектелеміз. Көбінде бұндай адсорбцияның 2 түрлі жағдайын қарастырамыз. Олардың біріншісі - молекулалық адсорбция яғни бейэлектролиттердің адсорбциясы, екіншісі- электролиттердің адсорбциясы, бұл электролиттің иондарының бірін таңдамалы түрде адсорбциялағанда болады. Енді осыларға жеке-жеке тоқталайық.
2.8.1. Ерітіндінің молекулалық адсорбциясы. Ерітінділердің қатты денеге адсорбцияланған үш жағдайын қарастырайық: Егер еріген заттың молекулалары еріткіштің молекулаларына қарағанда адсорбенттің бетіне көп адсорбцияланса, онда оң адсорбция болады (Г>0). Егер еріткішіміз адсорбенттің бетінде еріген заттан көп болса, теріс адсорбция Г<0, ал егер еріген заттың концентрациясы адсорбенттің беті мен ерітінді көлемінде бірдей болса, онда адсорбция болмайды Г=0. Осы үшеуінің ішіндегі практикалық маңызы зоры оң адсорбция. Оң адсорбция кезіндегі адсорбенттің ерітіндіден молекулалық адсорбцияланған заттың мөлшерін
Мұндағы С0- және С1 адсорбенттің бастапқы және тепе-теңдік концентрациясы, моль/л; V-адсорбцияға түсетін ерітіндінің көлемі, л; m- адсорбенттің массасы, г. 1000-ауыстыру коэффициенті (өлшейтін шаманы ммоль/г айналдыру үшін). Егер қатты дененің беті белгілі болса, онда адсорбция шамасын 1 өлшем бетке есептейді (көбінде 1 см2-қа тең). Көпшілік жағдайларда егер сұйылтылған ерітінділер үшін молекулалық тепе-теңдік адсорбцияның адсорбтивтің концентрациясына байланыстылығын өзімізге белгілі Фрейндлих немесе Лэнгмюр теңдеуімен көрсетуге болады. а)Еріткіштің табиғатының молекулалық адсорбцияға әсері. Ерітіндінің қатты дене бетіндегі адсорбциясы бәсекелік адсорбция екенін айттық. Ендеше неғұрлым еріткіш бетте нашар адсорбцияланатын болса, соғұрлым еріген затымыз жақсы адсорбцияланады. Басқаша айтқанда заттардың беттік керілуін еске алсақ (БАЗ-дың беттік керілуі аз шама) еріткіштің беттік керілуі неғұрлым көп болса, соғұрлым ол бетте нашар адсорбцияланады да, керісінше еріген зат бетте жақсы адсорбцияланады. Міне осы себепті қатты дене бетінде судағы ерітінділердің адсорбциясы органикалық ерітінділердің адсорбциясынан күшті болады. Органикалық еріткіштердің беттік керілуі аз шама екені бізге бұрыннан мәлім. Ерітінділердің қатты дене бетіндегі адсорбциясын еріткіштерді жұғу жылуы, диэлектрлік өтімділігі сияқты шамалармен сипаттауға болады. Егер еріткіш адсорбтивті өте жақсы ерітетін болса, онда адсорбция нашар болады. Бұл-Траубе-Дюкло ережесінен шығатын қорытынды. Шындығында да, егер қаныққан органикалық қышқылдардың органикалық еріткіштегі (мысалы бензолдағы) ерітіндісін гидрофильдік адсорбенттік (мысалы SiO2) адсорбциялайтын болсақ, онда қышқылдардың молекулалық салмақтары өскенде олардың адсорбциясы өспейді, қайта Траубе-Дюкло ережесіне керісінше азаяды. Өйткені жоғарыда айтылған органикалық қышқылдардың молекулалық салмақтары өскен сайын олардың бензолдағы еруі де күшейеді. Ендеше олардың адсорбциясы азаяды екен. Ерітіндінің қатты дене бетіндегі адсорбциясына еріткіштің табиғаты ғана емес сонымен қатар адсорбент пен адсорбтивтің қасиеттері де әсерлерін тигізеді. Енді соған тоқталайық. ә) Адсорбент пен адсорбтивтің қасиеттерінің әсерлері. Адсорбция шамасына адсорбенттің полярлығы мен уақ тесіктерінің әсерлері де өте күшті болады. Полярлы адсорбенттердің полярлы адсорбтивті, ал полярлы емес адсорбенттердің полярлы емес адсорбтивтерді жақсы адсорбциялайтыны белгілі. Адсорбенттердің уақ тесіктерінің адсорбцияға әсерлері сол адсорбтивтің молекулалары мен уақ тесіктерінің шамаларының қатынасына байланысты болады. Егер тесік шамалары өссе, ал адсорбтив молекулаларының шамасы аз болса ерітіндінің қатты денедегі адсорбциясы көбейеді. Ал адсорбтивтің молекулаларының шамалары тесіктердің шамаларынан жоғары болса, онда олардың тесікке енуі қиындайды да, адсорбция шамасы да аз болады, иә адсорбция нашарлайды. Әрине егер қатты дене беті тегіс болса, онда жоғарыда да айтылғандай болмайды. Адсорбцияға адсорбтивтің химиялық табиғатының да әсері күшті. Алайда бұлардың арасындағы байланысты тікелей жалпы түрде айтуға болмайды. Өйткені бірдей адсорбтивтердің өзі адсорбент пен ортаның (яғни еріткіштің) полярлығына байланысты әртүрлі адсорбциялануы мүмкін. Соған қарамастан адсорбцияның адсорбтивтік табиғатына байланыстылығы Ребиндер ұсынған полярлықты теңгеру ережесімен анықталады. Бұл ереже бойынша С адсорбтивінің адсорбциясы егер ол бөлу бетін түзетін фазалардың (А және В фазалары) полярлығын теңестіруге тырысатын болса, яғни А мен В фазаларының полярлығының айырмашылығын азайтатын жағдайда ғана болады. Басқаша айтқанда С-ның адсопрбциясы оның диэлектрлік өтімділігі А мен В фазаларының диэлектрлік өтімділіктері ( Бұдан неғұрлым еріген зат пен ерітіндінің полярлығының айырмашылығы көп болса, соғұрлым затымыз еріткіште нашар ериді. Ендеше оның беттегі адсорбциясы жақсы болады. П.А.Ребиндердің ережесі бойынша БАЗ молекулалары адсорбент пен ортаның бөлу беттерінде полярлық бөлігімен полярлық фазаға полярлық емес бөлігімен полярлық емес фазаға қарап орналасады. Оны сұлбалық түрде былай көрсетуге болады.
2.7-сурет. Әртүрлі бөлу беттерінде дифильдік молекулалардың орналасуы.
Бұл жоғарыда айтылған жалпы жағдайлардың басқа адсорбция шамасының неге байланыстылығын көрсететін белгілі бір жағдайлар үшін қолданылатын дербес ережелер бар. Мысалы заттың молекулалық салмағы артқан сайын оның адсорбциясы да күшейеді. Міне бояғыш заттар мен алколоидтардың жақсы адсорбциялануы осы себептен, яғни олардың молекулалық салмақтары өте жоғары. Ароматтық заттардың алифаттық заттардан, ал қанықпаған қосылыстардың қаныққан қосылыстардан жақсы адсорбцияланатыны сияқты т.б. дербес ережелерді де айта кеткен жөн. б)Температура мен ерітінділердің концентрацияларының әсерлері. Газға қарағанда сұйықтықта диффузия шамасының аздығына байланысты ерітіндінің адсорбциясы газдың адсорбциясынан баяулау жүреді. Оны жылдамдату үшін көбінде жүйені араластыру керек. Әсіресе үлкен молекулалардың өте уақ тесікті, яғни капиллярлы адсорбенттегі адсорбциясы өте баяу жүреді. Міне бұндай жағдайлар үшін адсорбцияның тепе-теңдік жағдайы өте баяу қалыптасады, кейде тіпті тепе-теңдік болмайды да. Температура көбейген сайын ерітіндінің беттегі адсорбциясы нашарлайды, әрине егер газдардың адсорбциясымен салыстырсақ, онда ерітіндінінің адсорбциясының кемуі баяулау болады. Алайда кейбір жағдайларда температура өскен сайын нашар еритін адсорбтивтің еріткіште еруі өседі де, ерітіндінің тепе-теңдік концентрациясының өсуіне байланысты адсорбция шамасы да өсуі мүмкін. Мысалы бұндай құбылыс гептандағы нафталиннің гидроксильденген SiO2 бетінде адсорбцияланғанын да байқауға болады. 2.8-суретте Гиббстік адсорбция шамасының (Г) адсорбтивтің мольдік үлесінің өсуіне (N) байланыстылығы сұлбалық түрде көрсетілген. Бұндағы 1-қисық алдымен өте жылдам көтеріліп максимум арқылы өседі де, одан 0-ге дейін төмендейді. Бұл 1-қисығымыз адсорбтивтің күшті, ал еріткіштің нашар адсорбцияланғандағы N-нің белгілі бір мәнінде адсорбцияның кемуі N-нің жоғары, мәнінде бет пен көлемде адсорбтивтің концентрациясы өте көп болады да және бірдей болады.
2.8-сурет. Г-нің адсорбтивтік мольдік үлесіне (N) байланыстылығы.
Ал суреттегі 2-ші изотерма теріс адсорбцияны сипаттайды, яғни адсорбтив нашар, ал еріткіш өте күшті адсорбцияланғандағы Г мен N-нің байланыстылығын көрсетеді. Бұл адсорбцияның да абсолюттік мәні алғаш түзу сызықты өсіп, максимумге жетеді де, ал адсорбтивтің концентрациясы өте жоғары болғанда 0-ге жетеді. Ал 2.8-суреттегі 3-изотерма компоненттерді нашар адсорбцияланғандағы Г мен N-нің арасындағы байланыстылықты көрсетеді. Бұл жағдайда Гиббстік адсорбцияның алғаш оң болып, N-нің белгілі бір мәнінен бастап оның шамасы теріс болатыны көрініп тұр. Бұл да N-нің жоғары мәнінде 0-ге тең болады. Изотерманың (3) абцисса осімен қиылысу нүктесінде көлем мен беттегі ерітіндінің концентрациясы бірдей, бұндай жағдайда қарастырып отырған адсорбентіміз қоспаларды бөле алмайды. Бұл құбылысты адсорбциялық изотропия деп атайды. Тағы бір айтып кететін нәрсе егер полярсыз еріткіштегі БАЗ-дың ерітінділерінің адсорбциясын қарастырсақ, кейбір жағдайларда БАЗ қалыңдығы 0,05-0,5 мк болатын полимолекулалық қабаттар түзеді екен. Б.В.Дерягин мен Г.И.Фукстің шәкірттерімен бірге жасаған еңбектерінде ондай қабаттардың механикалық қасиеттері ерітіндінің қасиеттерінен өзгеше және сол БАЗ-дың құрылысы мен молекулалық салмағына байланысты болатындығы көрсетілген. 2.8.2.Ерітінділердің адсорбциясының маңызы |
|
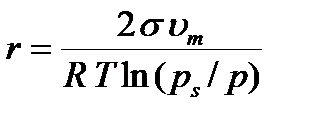

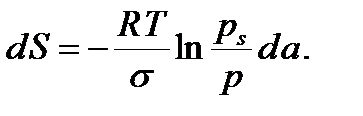
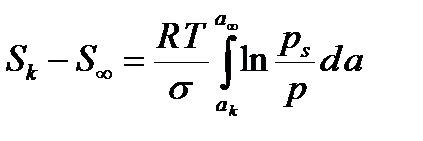
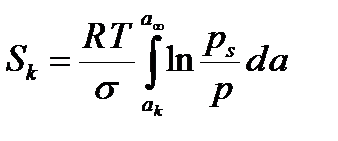



 формула бойынша былайша табуға болады.
формула бойынша былайша табуға болады.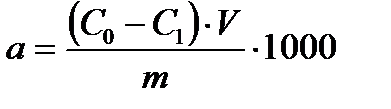
 және
және  ) аралығында болса жүреді
) аралығында болса жүреді  >
> 
