|
|
Электролитпен коагуляциялау кинетикасы 3 главаШеттік бұрыш пен адгезия және когезия жұмыстарынан басқа жұғу құбылысын жұғу жылуы арқылы да сипаттауға болады.
1.4.3. Жұгу жылуы
Сұйықтық бетке жұққанда онда беттің бос энергиясы азаяды. Беттік бос энергиясының азаюын жұғу кезінде бөлініп шыққан, жұғу жылуы деп аталатын жылу арқылы анықтауға болады. Бұл 1 см2 бет үшін 10-5 пен 10-3 калория арасында болатын шама. Мысалы үшін, 1 см2 кварцтың беті сұйықтық жұққанда 10-3 кал. жылу бөлінеді, бөлінген жылудың шамасы температура өскен сайын азаяды. Егер тегіс жазық бет болса онда жұғуды шеттік бұрыш арқылы, ал ұнтақ денелер үшін – жұғу жылуы арқылы сипаттаған қолайлы. Соңғы жағдайда жұғу жылуын 1г ұнтақ зат үшін анықтайды. Жұғу жылуын q әріпімен белгілейді. Егер полярлы сұйықтық болса онда жұғу жылуын q1, егер полярсыз сұйық болса q2 деп белгілейді. Гидрофильдік беттер полярлық сұйықтықтармен /мысалы, су/, ал гидрофобтық беттер полярсыз сұйықтықтармен /мысалы, бензол/ көп жұғу жылуын береді. Жұғу жылуы бөлшектердің диеперстілігіне байланысты екені дәлелденген. Сол себепті жұғу құбылысын, яғни бетті сипаттау үшін q шамасы емес, П.А. Ребиндер ұсынған дисперстілікке байланыссыз Флотация
Кендерді байытудың бір әдісі – флотация таңдамалы жұғу құбылысына негізделген. Флотацияның негізін түсіндіру үшін гидрофобтық және гидрофильдік минералдық бөлшектердің су мен ауа немесе су мен май бетіндегі жағдайын қарастырайық /1.7 сурет/.
1.7. – сурет. Флотация кезінде бөлшектердің бөлінуі
Гидрофильдік бөлшекте /SіО2/ су жұғатын болғандықтан, су мен бензол арасындағы беттік керілу күші оны суға тартады. Оның үстіне оның ауырлық күші де осы бағытпен әсер етеді. Осылардың нәтижесінде SіО2 бөлшегі ауа мен суға малынып, ақыр аяғында судың түбіне шөгеді. Ал гидрофобтық бөлшек /көмір/ су жұқпайтын болғандықтан су мен бензол арысындағы беттік керілу күшінің әсерінен осы фазалар арасындағы бөлу бетінде қалады. Әрине егер бөлшек өте үлкен болмаған жағдайда,ал бөлшек өте үлкен болса онда оның ауырлық күші флотациялық күштен басым болып оның да шөгуі ықтимал. Сол себепті флотация кезінде бөлшекті бөлу бетіндегі қалатындай етіп ұнтақтау керек. Практикада флотация жақсы болу үшін минералдың оңтайлы шамасы 0,15-0,01 мм болған жөн. Ал егер бөлшек тым кіші болса флотация үшін ол да тиімсіз. Өйткені броундық құбылыстың әсерінен оларды бөлу бетінде болу ықтималдылығы да азаяды. Күкіртті қосылыстардың беттерінің гидрофобтық қасиет көрсететінін білетінбіз. Ендеше олар флотация кезінде су бетінде қалқып шығып май мен су аралықтарында болады. Ал қоспалар гидрофильдік болғандықтан суға шөгіп кетеді. Міне осылайша кендерді флотация әдісімен байытуға болады. Бұл қарастырылған флотацияның түрін - майлы флотация деп атайды. Өңдірісті майлы флотация өте қымбатқа түседі. Өйткені органикалық еріткіштерді өте көп мөлшерде жұмсау керек. Оларды ықшамдау мақсатымен практикада кебінде майлы емес, көбіктіфлотация қолданылады. Көбікті флотацияның майлы флотациядан айырмашылығы флотация кезінде минералдың жүзгіндеріне әртүрлі тәсілдермен ауаның көпіршіктерін кіргізеді. Ауа көпіршіктері жүзгін бетіне көтеріле отырып өзімен бірге суда ерімейтін гидрофобтық бөлшектерді де ілестіреді. Соның нәтижесінде жүзгін бетінде минералдық бөлшектерден тұратын көбік пайда болады. Ал су жұғатын бөлшектер ауа көпіршіктері ілеспей жоғарыда айтқандай, шөгеді.
Флотация үдерісінің тиімділігін арттыру үшін флотациялық реагенттер қолданылады, олар әрекет ету сипаты бойынша үш класқа бөлінеді: жинағыштар, көбіктүзгіштер және реттегіштер. Олардың көпшілігі бетті-активтік заттар болып табылады. Жинағыштар(коллекторлар) – флотацияланатын минерал бөлшектерінің бетін гидрофобизациялауды және фазааралық керілудің σқс көбеюін және σқг кемуін, яғни нәтижесінде – жұғу бұрышының үлкеюін қамтамасыз етеді. Жинағыштар минералдың бөлшектерімен (немесе бос жыныстың бөлшектерімен) селективті сорылуы керек, сол себепті, олар әдетте ерекше химиялық күштердің көмегімен беттерде бекітіледі. Олардың молекулаларының аталған минералға ерекше жақындыққа ие полярлық бөлігі және полярлық емес – көміртектік радикалы бар, олар бөлшектердің беттерін гидрофобизациялайды және газдың көпіршігіне оның «жақындығын» қамтамасыз етеді. Мысалы, мыс және қорғасын кендерін флотациялық байыту барысында, осы металдардың иондарымен ерімейтін қосылыстарды түзетін ксантогенаттарды қолданады.
Pb(OH)2 +2ROCS-2 → Pb(-S-C=S)2 +2OH- | OR
Сілтілік-жер металдармен ерімейтін қосылыстар түзу, сол сияқты ауыр шпатты BaSO4, флюоритті СаҒ2 және оларды әртүрлі оксидтерден бөлуді флотациялау барысында жинағыш ретінде олеин қышқылын қолдану тиімді болады. Көбіршіктердің тұрақты жоғары дисперстілікті болып түзілуі флотация үдерісінің тұрақтылығына, көбіктің минерал бөлшектерімен тиелуінің көбеюіне ықпал етеді. Осы мақсатта жүйеге әдетте көбіктүзгіштер, мысалы ұзынтізбекті спирттер, кетондар, шыршалық майлар қосады. Көбіктүзгіштердің және жинағыштардың артық көлемде болуы cудың беттік керілуін σсг күшті төмендетуі мүмкін, ол бөлшек пен көпіршік арасындағы адгезияның жұмысын төмендетеді, осыған орай флотацияның тиімділігін төмендететінін ескеру қажет. Одан басқа, көбіктүзгіш жабысқаннан кейін жинағыштың қабыршағына түседі, ол да бөлшектер мен көпіршіктердің арасындағы жанасудың тұрақтылығына кері әсер етеді. Реттегіштерді флотациялық үдерістің талғамдылығын арттыру үшін олар рН-ты (қышқылдықты, сілтілікті) өзгертеді, минералдың жұқтығыштығын төмендетеді және флотацияны активтендіреді (флотациялық – активті иондардың тұздарды, мысалы, минералдың бетінде гидрофобтық сульфидтер түзу үшін натрий сульфидін), бос жыныстың жұғуын жақсартады, пульпадағы иондардың зиянды әсерін азайтады және т.б. Флотацияның тиімділігі көп дәрежеде үдерістің кинетикалық параметрлерімен анықталады. Соңғы кезде иондық-молекулалық немесе коллоидтық дисперстіліктегі заттар бөлшектерінің көбіктің бетіне шығу қабілеттілігіне негізделген иондық және молекулалық флотация көбірек қолданылуда. Бұл кезде, әдетте, жинағыштар (коллекторлар) иондармен ерімейтін гидрофобтық қосылыс түзеді.
1.8. – сурет. Беттің гидрофобизациялануы (а)
Қатты дене бетті беттік активтік заттар адсорбциялануының нәтижесінде табиғатын өзгертуін беттің гидрофилизациялануы, иә гидрофобизациялануы деп аталады. Мысалы, 1.8а суретте гидрофильдік бет /SіО2/ гидрофобизацияланып, ал гидрофобтық бет бетті-активтік зат адсорбциялануының нәтижесінде гидрофильденіп тұр (1.8б сурет). Флотация әсіресе өте сирек кездесетін және кен құрамында өте аз мөлшерде болатын қатты заттарды байытып, бөліп алу үшін өте кең тараған, әрі қолайлы әдістердің бірі болғандықтан, оның өндірістерде қолдануы жылдан жыл асқан сайын үздіксіз кеңейіп келеді.
1.6. Капиллярлық қысым
Біз беттік керілуді қарастырғанда ішкі молекулалық қысым деген ұғыммен танысқан болатынбыз. Бұл шама сұйықтықтың табиғатына байланысты болады. Мысалы ол су үшін - 11800, спирт үшін - 2400, эфир үшін – 1400 атм, осыған сәйкес ол сүйықтықтардың беттік керілуі /σ/ су үшін – 73,8, спирт үшін 22,03 ал эфир үшін 16,5 эрг / см2. Молекулалық қысым сұйықтықтың табиғатына емес оснымен қатар беттің пішініне де байланысты болады. Төменгі 1.9 – суреттегідей 3 жағдайды қарастырайық. Бірінші түтікшедегі сүйықтықтың беті ойыс /АI ВI /. екіншісінде тегіс /АII ВII/, ал үшіншісінде деңес /АIII ВIII/. Жазық тегіс беттегі молекулалық қысымды қалған екі түтікшедегі қысымдармен салыстырайық.
1.9. – сурет. Молекулалық қысымның беттің
Сұйықтық бетінен Міне осы капиллярлық қысым әрқашанда беттік керілу сияқты бетке перпендикуляр бағытталған. Міне осы беттің қысымы оның қисықтылығына байланысты екенін еске ала отырып кезкелген сұйықтықтың тамшысы әрқашанда шар тәрізді пішінге көшетінін көрсетуге болады. 1.10 – суретте көрсетілгендей тамшы бетінің әртүрлі қысықтылығына сәйкес әртүрлі қысымдар болады. Міне соның нәтижесінде сұйықтық тамшысы тепе-теңдік күйінде болу үшін өзінің пішіні сол әртүрлі күштер теңескенше өзгертеді. Ал ол шар тәрізді болғанда ғана теңеледі.
1.10. – сурет. Беттің қысымының оның қисықтылығына тәуелділігі Беттің қысықтылығы көбінде қисықтылық радиусы R арқылы сипатталады. Егер бет деңес бөлса, радиус сұйықтық жаққа бағытталған, бұл жағдайда радиустың мәні оң болады /R>O/. Егер бет ойыс болса, қысымның радиусы сұйықтықтың сырт жағына қарай бағытталған, онда радиус теріс болады /R<O/. Ал жазық тегіс бет үшін радиус өте шексіз шама деп қарастырылады /R= ∞ /. Капиллярлық қысым Р мен беттің қисықтылық радиусының арасындағы байланысты Лаплас теңдеуі бойынша көрсетуге болады:
Бұл Лаплас заңының жалпы жағдайын көрсетеді; Егер бет шар тәрізді болса /R1= R2/ онда жоғарғы теңдеуді аламыз. Егер R1= R2= ∞ болса, онда бет жазық, яғни тегіс бетте капиллярлық қысым болмайды. Лаплас заңы капиллярлық құбылыстың негізгі теориясы. Бұл заң бойынша капиллярлық қысымның беттік керілу өскен сайын және қисықталық радиусы азайған сайын көбейетінін көруге болады. /жоғарғы теңдеуді қара/. Бұл заң бойынша беттік керілу мән қисықтылық радиусы белгілі жағдайда капиллярлық қысымның есептеп шығаруға болады. Мысалы, су үшін σ=73 дин/см; Егер R=10-5 cм болса, онда Р=73•2•10-5 ≈ 15 атм, Бұл судың буына қарағанда оның тамшысында қысымының 15атм артық екенін көрсетеді. Кез келген сұйықтыққа батырылған түтікшенің табиғатына байланысты оған сұйықтық жұғуы, иә жұқпауы мүмкін. Мысалы үшін шыны түтікшеге су жұғады да, ал сынап жұқпайды. Осыған байланысты түтікшедегі сұйықтықтың беті қисық болады да, ел беттің қысымы жазық беттік қысымынан өзгеше болады. Сол себепті сұйықтыққа түтікше бойымен оны жоғары көтеретін күш пайда болады да /әрине егер сұйықтық жұғатын болса, онда бет ойыс болады/, ол күш сұйықтықты деңгейдегі сұйықтықтың салмағы мен көтеретін күш теңеспейінше жоғары көтереді. Керісінше сұйықтық жұқпаса, түтікшедегі сұйықтықтың деңгейі төмен түседі. Енді сұйықтықтың түтікшедегі көтерілу биіктігі (h) деңгейдің радиусы (R), түтікше радиусы r, шеттік бұрыш Ө, сұйықтықтың беттік керілуі σ арасындағы байланысты анықтайық. Бұл үшін төмендегі 1.11-суреттегідей жұғатын сұйықтықты алып қарастырайық.
1.11. – сурет. Жюрен теңдеуін қорытуға арналған Жоғарыда айтылғандай сұйықтық деңгейдегі сұйықтық салмағы сол сұйықтықты көтеру күшіне Ғ теңескенше жоғары көтеріледі. h биіктікте осы күштер өзара теңеседі деп қарастырсақ: Q=F, Мұндағы F= σ2πr мұндаған r-түтікшенің радиусы. σ-сұйықтықтың беттік керілуі. Ал h деңгейді сұйықтықтың салмағы Q=πr2•h•d•g; h-деңгейдің биіктігі; d - сұйықтықтың тығыздығы. g - еркін түсу үдеуі /981 см/с2. Суреттен геометриялық жолмен Ендеше Бұл теңдеуді Жюрен теңдеуі деп те айтады. Егер сұйықтық түтікшеге жұқпайтын болса онда Ө>900, CosӨ<0 ендеше Жюрен теңдеуі бойынша h<0, яғни сұйықтық түтікшемен жоғары көтерілмей, төмен түседі. Егер сұйықтық толық жұқса CosӨ=1, онда мынадай қарапайым теңдеуді жазуға болады.
Бұл формула бойынша сұйықтықтың көтерілу биіктігін есептеуге болады. Мысалы, су үшін жуықтап есептелген мәліметтер мынаны көрсетеді: r h 10-1см=1мм 1,5 см 10-4см=1мк 15м 10-7см=1 нм 15 км
Жер қыртысы мен топырақ бойындағы судың капиллярлық көтерілуінің өсімдіктер үшін маңызы зер. Сол себепті кейде топырақ құрғап кетпес үшін, капиллярлық каналдарды бұзу мақсатымен агретехникада әртүрлі шаралар / тырмалау, малалау/ қолданылады. Тұрғын үйлер мен басқа құрылыстарда судың капиллярлық көтерілуін тоқтату үшін үйдің іргетасы мен қабырғасының арасына гидроизоляциялық материалдар қояды. Басқа да жолдары бар, мысалы, электроосмос арқылы көтерілген ылғалды кетіру. Капиллярлық көтерілу биіктігін өлшеу арқылы, сұйықтық пен газ арасында беттік керілуді есептеуге болады. /5 бет – 1 әдіс/, Сонымен жоғарғы суреттен дөңес беттен жазық және ойыс беттерге қарағанда молекулалары оңай буға айналатыны көруге болады, басқаша айтқанда дөңес беттегі сұйық буының қысымы жазық беттегі сұйықтықтың қалыпты қысымынан көп болады, ал ойыс беттегі сұйықтық буының қысымы одан аз болады. Бұны Томсон /Кельвин/ теңдеуі бойынша көрсетуге болады:
Р - қаныққан будың қисық беттегі қысымы. РS- Жазық беттегі қанық будың қысымы. Томсон теңдеуін қорытып шығару физика курсында қарастырылатындықтан, жоғарғыда біз оны даяр күйінде бердік. Томсон теңдеуі капиллярлық конденсация құбылысын түсіндіру үшін қажет есептеудің негізі болып табылады. Егер РS және капиллярдың радиусы белгілі болса, онда Рһ яғни, одан жоғарғы қысымда конденсация болатын қысымды есептеуге болады. Егер Рһ, Рs белгілі болса, онда керісінше капиллярдың максимальдық радиусы /яғни конденсация болатын радиусын/есептеуге болады. Ал соңғы жағдай адсорбенттерді дұрыс таңдауға мүмкіншілік береді.
Екінші бөлім АДСОРБЦИЯЛЫҚ ҚАБАТТАР ЖӘНЕ ОЛАРДЫҢ ДИСПЕРСТІК ЖҮЙЕЛЕРГЕ ӘСЕРЛЕРІ
2.1 Адсорбция туралы түсініктер Гетерогендік жүйелердің бөлу беттерінде болатын құбылыстардың ішінде теориялық және практикалық жағынан маңызы зор көп тараған құбылыстардың бірі - сорбциялық құбылыстар. Сорбция деп бір заттың басқа бір затқа өздігінен жұтылу құбылысын айтады. Жұтылатын (сіңірілетін) затты сорбтив деп, ал өзіне жұтатын (сіңіретін) затты сорбент деп атайды. Сорбциялық құбылыстар сорбтивтің қозғалатын бөлшектерінің сорбентке қаншалықты терең енгеніне және олардың арасындағы әрекеттесу шамасына байланысты әртүрлі болып келеді де, соған лайықты әр түрлі аталады. Барлық сорбциялық құбылыстар бөлу беттерден басталғанымен олар екі түрлі аяқталуы мүмкін. Сорбтивтің қозғалатын бөлшектері сорбенттің бүкіл көлеміне, иә тек олардың беттік қабатында ғана жиналады. Бірінші жағдайдағы сорбцияны көлемдік сорбция, иә абсорбция дейді де, ал екінші жағдайдағысын-беттік сорбция, иә адсорбция дейді. Мысалы үшін Н2-нің Рt-да жұтылуы адсорбциялық құбылыс болса, ал оның Рd-де жұтылуы-абсорбциялық құбылыс. Адсорбция кезінде жұтатын және жұтылатын заттарды адсорбент және адсорбтив деп атайды. Кейбір оқулықтарда адсорбтивтің орнына адсорбат деп атайды, дұрысы адсорбтив. Олай дейтініміз адсорбат деп кейбір ғалымдар адсорбтивтің адсорбцияланған күйін (яғни адсорбентпен біріккен күйін) қарастырады. Адсорбцияның дисперстік жүйелер үшін маңызы көп. Коллоидтық жүйелердегі лиокірнелердің коагуляциясы, коллоидтық тұнбалардың пептизациясы, бөлшектердің зарядтарының өзгеруі сол сияқты т.б. құбылыстар адсорбциямен өте тығыз байланысты. Газдардың көмірдегі адсорбциясын XIX ғасырда неміс ғалымы Шееле байқаған болатын. Ерітінділердің адсорбциясын ең бірінші 1785 жылы орыс академигі Г.Е.Ловиц көрсеткен болатын. 1814 жылы франциялық ғалым Соссюр барлық саңлаулы қатты денелердің газдарды жұта алатындығын және бұл құбылыс кезінде жылу шығатынын тапты. Соссюр оңай қысылатын (сұйылатын) газдардың жақсы адсорбцияланатынын байқады. XIX ғасырдың аяқ кезінде Гиббс адсорбцияның жалпы термодинамикалық теориясын жасады. XX-ғасырда адсорбция құбылыстарын Лэнгмюр, Поляни Брунауэр, Де-Бур, ал Кеңес Одағында Л.Т.Гурвич, Н.А.Шилов, М.М.Дубинин, А.В.Кисилев сияқты т.б. ғалымдар түпкілікті зерттеді. Зелинский 1915 жылы противогазды ойлап тапты. Адсорбция шамасын адсорбтивтің салмақтық саны жағынан көбінде X деп белгілейді. Егер адсорбция құбылысын қарастырса бірлік беттегі (S), ал егер абсорбциялық құбылысты қарастырса бірлік массада (m) адсорбтивтің шамасын алған жөн. Бірінші жағдай үшін адсорбция шамасы екінші жағдай үшін адсорбция шамасы Г шамасы белгілі бір адсорбент пен адсорбтив үшін 2 термодинамикалық параметрлерге тәуелді болады. Егер адсорбтив газ болса температура (Т) мен қысым (Р), егер адсорбтив сұйықтық болса, температура (Т) мен концентрацияға (С) байланысты болады. Сонымен үш шама Г,Т,С немесе (Р) арасында белгілі бір функциялық байланыс бар екен. Оны математикалық жолмен жалпы термодинамикалық теңдеу бойынша көрсетуге болады:
f(Г,Т,С) = 0 немесе f(Г,Т,Р) = 0 (2) бұдан: Г = f(Т,С) немесе Г=f(Т,Р) (3)
Бұл жалпы теңдеуден дербес теңдеулерді жазуға болады. Егер температура тұрақты болса, Т = const, онда: Г = f(С), немесе Г=f(Р) (4) 4- теңдеуді адсорбция изотермасының теңдеуі деп атайды. Егер қысым тұрақты болса, Р=const, онда мынадай теңдеу жазуға 5-теңдеуді адсорбция изобарасының теңдеуі деп атайды. Егер қоюлық (концентрация) тұрақты С=const болса, онда Г= f(Т) (6) 6-теңдеуді адсорбция изопикнасының теңдеуі деп атайды. Егер адсорбция мөлшері тұрақты болса (Г=const), онда қоюлық пен температура арасындағы байланыс мынадай түрде болады: С= f(Т) (7) 7-теңдеуді адсорбция изостериясының теңдеуі деп атайды. Бұл теңдеулердің әр түрлі жағдайлар үшін функциялардың өз ара байланысын (түзу сызықты, кері, көрсеткіштік логарифмдік т.б.) көрсететін нақтылы түрлерін молекулалық кинетикалық түсініктер негізінде (мысалы, изотерма теңдеулері үшін, иә тікелей термодинамикалық тәсілдермен) қорытуға болады. |
|
 шамасын қолдаған өте қолайлы. Гидрофильдік беттер үшін β > 1, ал гидрофобтық беттер үшін β < 1 болады.
шамасын қолдаған өте қолайлы. Гидрофильдік беттер үшін β > 1, ал гидрофобтық беттер үшін β < 1 болады.


 қашықтықтағы m молекуласын алайық, ол МN жазықтығындағы жатсын /2 түтікше/. Әрине бұл m молекуласынан төмендегі молекулалар оны төмен, ал жоғарғы жағындағы молекулалар жоғары тартады. Осының нәтижесінде екі күштің айырмашылығы сұйықтықтың қалыпты молекулалық қысымын Р2 тудырады. Егер біз m молекула тұрған МN жазықтығының жоғары жағындағы 3 түтікшедегі кеңістікті салыстырсақ, онда олардың әртүрлі екенін көреміз. 1-түтікшедегі ойыс бетте ең үлкен кеңістік, ендеше оны жоғарғы жағынан тартатын молекулалар саны да көп, соның нәтижесінде ойыс сұйықтық беттегі молекулалық қысым тегіс беттегі қысымнан аз бөлады. Керісінше дәл осы сияқты үшінші дөңес бетте қысымның жазық тегіс бетіндегі қысымнан көп екенін көруге болады. Міне қисық бет пен тегіс беттің молекулалық қысымдары әртүрлі болады екен. Осындай қисық бет пен жазық беттің молекулалық қысымдарының айырмашылығын, көбінде ол (түтікшілер), капиллярларда болатындықтан, капиллярлық қысым Р дейді.
қашықтықтағы m молекуласын алайық, ол МN жазықтығындағы жатсын /2 түтікше/. Әрине бұл m молекуласынан төмендегі молекулалар оны төмен, ал жоғарғы жағындағы молекулалар жоғары тартады. Осының нәтижесінде екі күштің айырмашылығы сұйықтықтың қалыпты молекулалық қысымын Р2 тудырады. Егер біз m молекула тұрған МN жазықтығының жоғары жағындағы 3 түтікшедегі кеңістікті салыстырсақ, онда олардың әртүрлі екенін көреміз. 1-түтікшедегі ойыс бетте ең үлкен кеңістік, ендеше оны жоғарғы жағынан тартатын молекулалар саны да көп, соның нәтижесінде ойыс сұйықтық беттегі молекулалық қысым тегіс беттегі қысымнан аз бөлады. Керісінше дәл осы сияқты үшінші дөңес бетте қысымның жазық тегіс бетіндегі қысымнан көп екенін көруге болады. Міне қисық бет пен тегіс беттің молекулалық қысымдары әртүрлі болады екен. Осындай қисық бет пен жазық беттің молекулалық қысымдарының айырмашылығын, көбінде ол (түтікшілер), капиллярларда болатындықтан, капиллярлық қысым Р дейді.
 бұл беттің қисықтылығы шар тәрізді болғанда орындалады. Егер бет элипсоидтық қисықтылығында болса, онда жоғарғы теңдеу былайша жазылады:
бұл беттің қисықтылығы шар тәрізді болғанда орындалады. Егер бет элипсоидтық қисықтылығында болса, онда жоғарғы теңдеу былайша жазылады: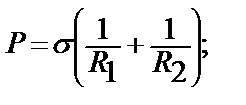

 екенін білуге болады.
екенін білуге болады.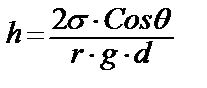
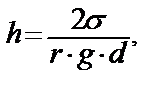
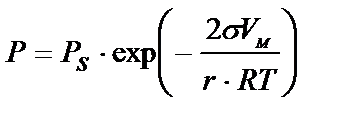
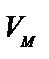 – сұйықтықтың мольдің көлемі. R – газ тұрақтысы Т – абсолюттік температура.
– сұйықтықтың мольдің көлемі. R – газ тұрақтысы Т – абсолюттік температура.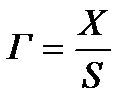 , ал
, ал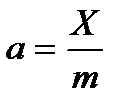 деп белгіленеді.
деп белгіленеді.