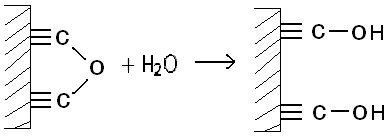|
|
Электролитпен коагуляциялау кинетикасы 8 главаЕрітіндінің адсорбциясының көптеген физика-химиялық үдерістердегі маңызы зор. Олар көбінде өсімдік және жануарлар организмдеріндегі көптеген процесстермен де тікелей байланысты. Қоректі заттарды сіңіру, алдымен олардың табиғи катализаторлардың-ферменттердің бетіне жиылуынан басталады. Техникада да молекулалық адсорбция көп қолданылады. XVIII-ғасырдың өзінде-ақ Т.Е.Ловиц көмір арқылы әртүрлі ерітінділерді тазартуға болатындығын көрсетті. Қазіргі кезде қанттың сироптарын тазарту активтік көмір арқылы жүзеге асырылады. Майлағыш сұйықтарды (немесе майларды) адсорбент ретінде қолданылатын топырақтар арқылы тазартуға болады. Көптеген өте аз тараған элементтерді ерітіндіден адсорбция арқылы бөліп алуға болады. Аналитикалық химияда өте қиын бөлінетін қосылыстарда да адсорбция арқылы бөлуге болады. 1903 ж орыс ғалымы М.С.Цвет адсорбцияға негізделген хромотография әдісін ашты. Бұл әдіспен Цвет құрамы күрделі хлорофилді жеке бөліктерге бөлді. Адсорбцияның хромотографияның негізін қысқаша былайша түсіндіруге болады. Түтікше (адсорбциялық колонка) арқылы әртүрлі заттар еріген ерітіндінің көп уақыт бойы жібереді. Ал түтікшеміз кез-келген адсорбентпен толтырылған. Мысалы, MgO, CaO, SiO2Al2O3 және т.б.
2.9-сурет. Хлорофиль хромотографиясы.
Міне ерітінді адсорбент арқылы өткенде түтікшенің жоғарғы жағында жақсы адсорбцияланатын заттар қалады да, ал төменгі жағында нашар адсорбцияланатын заттар жиналады. Әрине ерітіндіміз жоғарыдан төмен қарай стрелка бағытымен қозғалатын болса. Шындығында да адсорбенттің жоғары қабаттарында нашар адсорбцияланатын заттардың болуы мүмкін емес. Өйткені адсорбенттің бойымен ерітіндінің жаңа порциясы (бөлігі) өткенде нашар адсорбцияланатын заттарды күшті адсорбцияланатын заттар ығыстырып шығарады. Осының нәтижесінде әртүрлі құрамдастармен қаныққан түтікшеде көптеген аймақтар болады. Егер құрамдастар түсті болатын болса, оларды түсі арқылы ажыратуға болады. Егер құрамдастар түссіз болып бірақ люменесценциялық қабілеті болатын болса, олардың шекарасын аймақтарға ультракүлгін сәулелер түсіру арқылы анықтауға болады. Жеке құрамдастарды бөлу үшін аймақтардағы адсорбенттерді бір-бірімен араластырмай бөліп алады да, оларды адсорбцияланған құрамдастарды белгілі бір еріткіштер арқылы жиып алуға болады. Міне химиялық жолмен бөлінбейтін кейбір заттарды хроматография әдісімен осылайша бөліп алуға болады. Біз жоғарыда тек колонналық хроматография тәсіліне ғана тоқталдық. Әрине хроматографияның көптеген түрлері болады. Олар-ығысу, газдық, газ-сұйықтық, тұнбалық т.б. хроматографиялар. Олар толығырақ аналитикалық химия курсында қарастырылатын болғандықтан біз оларға жеке-жеке тоқталмаймыз. Қазіргі кезде хроматографиялық әдістер дәрілік заттарды, витаминдерді энзим, алкольид, т.б. заттарды бөлу үшін қолданылады. Жасанды жолмен алынған трансурандық элементтерді ашу үшін хроматографияның ролі күшті болды. Мысалы № 99 энштейний (Еs), № 100 фермий (Fm) және № 101 менделеевий (Md) элементтері хроматография әдісі бойынша бөлінген болатын.
2.8.3. Электролиттердің адсорбциясы.
Біз жоғарыда ерітінділердің молекулалық адсорбциясына тоқталдық. Егер ерітіндіміздегі еріген зат электролит болып келсе, онда олардың адсорбциясының өзіне тән ерекшеліктері болады. Күшті электролиттерді толық диссоцияланады деп қарастыруға болады. Ендеше оларды адсорбциялау тек адсорбциялық күштердің әсерімен ғана емес, сонымен қатар электрлік күштердің де әсерімен болады. Осыған байланысты ондай адсорбциялардың теория және практикаға маңызы зор өзіндік ерекшеліктері болады. Көбінде практикалық маңызы көп ерітінділер электролиттердің судағы ерітіндісі болғандықтан, төменде осындай ерітінділердің адсорбциясына тоқталамыз. а)Иондық адсорбция Электролиттердің иондарға адсорбцияланатынын айтып кеттік. Ендеше электролиттің адсорбциясы деп олтырғанымыз-сондағы иондарымыздың адсорбциясы. Олардың адсорбциясы адсорбенттердің табиғатына байланысты болады. Иондар поляризацияланатын болғандықтан олар полярлы молекулалардан тұратын, иә иондардан тұратын беттерде ғана адсорбцияланады. Сондықтан иондық адсорбцияны көбінесе полярлық адсорбция деп те атайды. Беттің зарядталған микроучаскелері өзінің зарядына қарама-қарсы зарядталған иондарды адсорбциялайды. Ал адсорбцияланбаған электролиттердің иондары электростатикалық тарту күштерінің әсерінен адсорбцияланған иондардың маңында болады да, олармен бірге бірігіп адсорбент бетінде қос электрлік қабат түзеді. Бұл қабаттың құрылысы жөнінде арнайы тарауда толығырақ айтамыз. Иондардың адсорбциялану қабілетіне олардың радиустарының әсерлері күшті. Егер бірдей валентті иондардың адсорбциясын қарастырсақ, онда неғұрлым ионның радиусы көп болған сайын соғұрлым оның адсорбциясы күшті болады. Бұның себебі екі түрлі. Біріншіден, радиусы үлкен болса, ол ионның поляризациясы күшті, сол себепті адсорбциясы да күшті болады. Екіншіден, егер оның ионның радиусы үлкен болса, оның гидратациясы азаяды. Ал гидратацияның иондар арасындағы адсорбцияны азайтатыны белгілі. Өйткені гидраттық қабаттар электрлік әрекеттесуді азайтады. Міне осының нәтижесінде ионның радиустары өскен сайын оның адсорбциясының да өсетіні көрініп тұр. Иондардың ортамен байланысуымен азаюына қарай орналасатын қатарды лиопроптық қатар, немесе Гофмейстр қатары деп атайды. Бір валентті катиондар үшін оны былайша жазуға болады: Li+ < Na+ < K+ < Rb+ < Cs+ Екі валентті катиондар: Mg2+ < Ca2+ < Sr2+ < Ba2+ ал бір валентті аниондар төмендегіше орналасады: Cl- < Br- < NO3- < I- < NCS- Иондардың адсорбциясы олардың валенттіліктеріне күшті тәуелді болады. Неғұрлым иондардың валенттіліктері жоғары болса, соғұрлым ол бетке күшті адсорбцияланады. Мысалы, әртүрлі валентті катиондар мен аниондар адсорбциялық қабілеттіліктері бойынша төмендегідей орналасады: K+ << Ca+2 << Al+3 << Th+4 және Cl- << SO4-2<<PO4-3<<[Fe(CN)6]-4 Кристалдардағы сол кристалдардың құрамында болатын иондардың адсорбциясының коллоидтық химияда маңызы зор. Бұл адсорбцияны кристализация құбылысы ретінде қарастыруға болады, яғни кристалдық торды сол иондардың толтыруы деп қарастыруға болады. Панет пен Фаянстың ережесі бойынша кристалдың торына тек сол кристалды түзетін иондар мен атомдар ғана орналасады. Мысалы, AgI кристаллы, КI - ерітіндісінде болса, онда бетке I ионы адсорбцияланады. Егер AgI кристаллы AgNO3 – ерітіндісіндеболса, онда Ag+ ионы адсорбцияланады. Кристалдық торды толтыру үшін тек кристалл құрамына кіретін иондар ғана емес, сонымен қатар оларға изоморфтық иондар және кристалдық тор түйіндеріндегі иондармен киын диссоцияланатын қосылыстар түзетін иондар да бетте адсорбцияланады екен. Мысалы, жаңағы AgI кристаллы үшін I- ионына изоморфты Br-, Cl- иондарын айтуға болады. Кристалдық тормен мықты байланысты кристалда болатын иондар ғана емес, сонымен қатар кристалдың бетінде болатын атомдар тобына жақын атомдар топтары да бере алады екен. Мысалы көмір органикалық радикалдарды күшті ұстаса, алюминий оксидтері мен гидроксидтері оттегісі бар топтарды өздерімен жақсы байланыстырады. 2.9. Иондардың алмасу адсорбциясы.
Егер адсорбент бетінде электролит адсорбцияланған болса, ондай адсорбенттерге басқа электролит жанасқанда алмасу адсорбциясын байқауға болады. Әрине алмасу адсорбциясы болу үшін ерітіндідегі иондардың сорбентке адсорбциялану ынтықтылығы бұрынғы адсорбцияланған иондарға қарағанда басым болуы керек. Алмасу адсорбциясы дұрысырақ айтқанда сорбенттің қос электрлік қабатымен ерітіндінің арасында болады. Алмасу адсорбциясы кезінде қос электрлік қабатқа қанша ион енсе, сонша ион ерітіндіге өтеді. Әрине адсорбцияланған ион мен ерітіндіге бөлінген иондардың таңбалары бірдей болады. Адсорбентке адсорбцияланған иондармен тек басқа текті иондар ғана емес, адсорбенттің молекулалары диссоциацияланатын жағдайдағы пайда болатын иондар да алмаса алады. Алмасу адсорбциясының көптеген ерекшеліктері бар. Соларға қосымша жеке-жеке тоқталғанымыз жөн. Біріншіден, алмасу реакциясының арнаулы бағыты болады, яғни белгілі бір иондар ғана алмаса алады. Басқаша айтатын болсақ, алмасу адсорбциясына қатты фазаның табиғаты оның электрлік қабатының құрылысының және адсорбцияланатын иондардың табиғатының әсерлері өте күшті. Адсорбенттердегі адсорбцияланған иондар мен ерітіндідегі олармен алмаса алатын иондардың химиялық табиғатына байланысты адсорбенттерді екі топқа бөлуге болады:қышқылдық және негіздік деп. Қышқылдық адсорбенттер қышқылдар сияқты ерітіндіде иондарға катиондарын ғана алмастырады, ал негіздік адсорбенттері негіздерге ұқсас тек аниондарды ғана алмастырады. Көптеген амфотерлік адсорбенттер де болады, олар белгілі бір жағдайда катиондарын алмастырса, басқа бір жағдайларда аниондарын ғана алмастырады. Алмасу адсорбциясының осы ерекшеліктері табиғаты жағынан химиялық құбылысқа (реакцияға) жақын екенін көрсетеді. Екіншіден, алмасу адсорбциясы барлық жағдайда қайтымды болмайды. Үшіншіден, алмасу адсорбциясы молекулалық адсорбциядан баяу жүреді. Егер адсорбенттің бетіндегі емес көлем ішіндегі иондары алмасуға түссе, онда алмасу адсорбциясы одан да баяу жүреді. Төртіншіден, алмасу адсорбциясы кезінде ортаның рН-ы өзгеруі мүмкін. Әрине бұл, егер адсорбенттің иондарымен алмасатын иондар сутек, иә гидроксиль иондары болған жағдайда болады. Егер адсорбент басқа катионға сутек ионын алмастырса, ортаның рН-ы азаяды, керсінше басқа анионға гидроксиль ионын алмастырса, ортаның рН-ы көбейеді. Бұларды сұлбалық түрде былайша көрсетуге болады:
Алмасу адсорбциясы кезінде қатты дене бетіндегі алмасатын иондарды (1 және 2 ион) сан жағынан Б.П.Никольский (1939 ж) теңдеуімен сипаттауға болады:
бұндағы g1 және g2 адсорбенттегі алмасатын иондардың мөлшері, г-экв/г.
Z1 және Z2 - иондардың валенттілігі. К-тұрақты шама. Егер Z1 =Z2 = 1 болса, онда бұл теңдеуді былайша жазамыз: g1/ g2 = К1( Егер электролиттің концентрациясы аз болса, онда активтілік (
g1/ g2 = К1(с1/с2)
Алмасу адсорбциясының егін шаруашылығы мен биология және техникада маңызы зор. Топырақ өзінің бойына белгілі бір иондарды ғана жұтып ұстай алады. Өсімдіктерге қажет тыңайтқыштардың құрамында болатын К+ және NH4†катиондарын топырақ өз бойында жақсы ұстайды. Бұл иондардың орнына топырақ өз бойынан Са++ және Мg++ катиондарын бөледі. Кейбір Cl-, NO3-, SO42- сияқты иондар топырақта тіпті жұтылмайды. Бұл жөнінде толық мәліметтер К.К.Гедроцудың (1983ж.) еңбектерінде көрсетілген. Техникада да алмасу адсорбциялары көп жағдайларда қолданылады. Мысалы мақта маталарын бояу үшін қолданылады. Бояу кезінде олар бояудың түсті катиондарын сіңіріп алып, техникалық үдерістер кезінде өздерінің бойында болатын Са++ катионын бөліп шығарады. Алмасу адсорбциясы кермек суларды жұмсату мақсатына кеңінен қолданылады. Кермек сулардың құрамында болатын Са++ және Mg++ иондары суды техникада қолдануды зиянды ететіні бізге белгілі. Сабындар кермек суда Са мен Mg-дің қосылыстарына айналып суда ерімейді де, оның үстіне өздерінің жуғыштық қасиетін жоғалтады. Кермек суда пісірілген тамақ дәмсіз және қатты болады, т.б. кермек судың тұрмыста зиянды болатынын көрсететін мысалдар көп. Міне осындай кермек суларды жұмсарту үшін Ганс алюмосиликаттық сорбентті пайдалануды ұсынды. Оны Ганс пермутит деп атады. Пермутиттің формуласын былайша көрсетуге болады: Na2O·Al2O3·3SiO2·Н2О Кермек суды пермутит арқылы жұмсатуға сұлбалық түрде былай жазуға болады.
Соңғы кездерде суды жұмсарту үшін пермутиттің орнына табиғи минералдар-глаукониттер және жасанды түрде алынатын ионалмастырғыш шайырларқолданылады. Ионалмастырғыш шайырлар жөнінде ҮМҚ химиясында толығырақ айтылады. Ионалмастырғыш шайырларды иониттер деп те атайды. Егер адсорбент шайырлар катиондарын алмастыратын болса, катиониттер, ал аниондарын алмастырса аниониттер деп аталады. Кәдімгі суда катиониттер мен аниониттер салынған ерекше сүзгілер арқылы өткізіп оларды еріген электролиттерден тазартып, тазалығы жағынан диссоциацияланған судай су алуға болады. Оны сұлбалық түрде төмендегідей көрсетуге болады:
Бұл үдеріс кезінде иониттеріміз өздігінен регенерацияланатын болғандықтан суды осылай тазарту өте қолайлы тиімді, әрі арзанға түседі. Алмасу адсорбциясы басқа жолмен алу қиын болатын өте сұйылтылған ерітінділерден керекті затымызды жиып алуға қолданылады. Осы жолмен мысалы, күмісті және көптеген радиоактивті металдарды ерітінділерден шығарып алуға болады. Алмасу адсорбциясы аналитикалық химияда ерітінділерді титрлеу кезінде эквиваленттік нүктені табу үшін қолданылады. Алмасу адсорбциясының өмірде қолдануы тек жоғары айтылған мысалдармен шектеліп қоймайды, оларды практикада қолдану жылдан-жылға кеңінен тарап келеді.
2.10. Көмір бетіндегі алмасу адсорбциясы Көмірдің полярлығының болмайтындығы бізге мәлім. Ендеше ол полярлы заттарды адсорбцияламау керек. Алайда көптеген тәжірибелер көмірдің электролиттер иондарын таңдамалы адсорбциялап ғана қоймай, онда алмасу адсорбциясы да болатынын көрсетті. Практикалық жағынан көмір негізгі қажетті адсорбент болғандықтан, онда болатын алмасу адсорбциясының себептеріне тоқталайық. Ағаш көмірінің алмасу адсорбциясына қабілеттілігі аз да болса онда болатын анорганикалық заттардың болуымен түсіндіруге болады. Мысалы, метилендік көктің ерітіндісінен бояудың катионын адсорбциялап, ал ерітіндіге түссіз Са++ катионын алмастырады. Алайда алмастыру алмасу адсорбциясына бойында ешқандай анорганикалық қосылыстар болмайтын таза көмірлердің өздері де бейім екен. Бұның себебін А.Н.Фрумкин дамытқан электрхимиялық түсініктер мен Н.А.Шилов және оның мектебінің ұсынған беттік қосылыстар туралы түсініктер бойынша түсіндіруге болады. А.Н.Фрумкин көмірді сутекпен қаныққан платина сияқты газдық электрод деп қарастырып, көмірдің бетінде сутектің адсорбциясы оны алу үдерісінде және активация кезінде болатынын айтты. Дәл осы сияқты көмірді алғанда, активтендіру және сақтау кезінде ол аздап оттекті де адсорбциялануы мүмкін. Сол себепті қандай газбен қаныққанына байланысты көмір иә сутектік, иә оттектік электрод тәрізді қасиет көрсетеді. Егер көмір бетіне сутек адсорбцияланса, онда ол су мен жанасқанда сутек ионын түзеді. Бұнда сутек атомы электронның доноры, ал көмір - акцепторы болады:
Бұндай көмірдің әрине ерітіндідегі катиондар мен алмасу адсорбциясына қабілеттілігі бар. Мысалы, егер ерітіндіде ас тұзы болса, онда алмасу адсорбциясын былайша көрсетуге болады:
Бұнда көмірді қышқылдық адсорбент деп қарастыруға болады. Ал адсорбция нәтижесінде ерітінді қышқылданады, яғни ерітіндініө рН-ы азаяды. Ал егер көмір бетінде оттек адсорбцияланса, онда ол сумен жанасқанда электрондардың доноры болады да, оттек акцепторы болады.
Тұрақсыз О2- ионы сумен әрекеттесіп гидрооксиль иондарын түзеді:
Әрине бұндай көмір ерітіндіде болса, оның негіздік адсорбенттік қасиет көрсететінін көруге болады. Ендеше ол өзінің гидроксиль иондарын кез келген иондарға алмастыра алады.
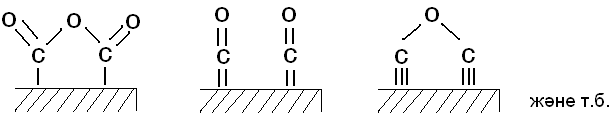
Бұндай алмасу адсорбциясының нәтижесінде бейтарап ерітіндіміз негіздік қасиет көрсетеді, яғни ерітіндінің рН-ы көбейеді. А.Н.Фрумкиннің теориясының дұрыстығын мынадан көруге болады. Егер көмір бетінен адсорбцияланған газды кетіретін болсақ, онда көмір ерітіндідегі иондарды жұту (яғни алмастыру) қабілеттілігін жоғалтады. Н.А.Шилов көмірдегі алмасу адсорбциясын басқаша түсіндірді. Оның теориясы бойынша активтендірген көмірді алу және оны активтендіру кезінде көмір бетінде адсорбенттің кристалдық тормен тығыз байланысқан оксидтердің өте жұқа қабаты пайда болады. Мысалы:
Бұл оксидтер сумен әрекеттесіп бір жағдайда карбоксилдік топ түзуі мүмкін. Мысалы:
Ондай жағдайда олар сутек ионын катиондармен алмастыратын болады. Ал басқа бір жағдайларда сумен әрекеттесіп гидрооксиль топтарын беруі мүмкін. Мысалы:
Бұндай жағдайларда олар гидрооксиль иондарын басқа бір аниондармен алмастыратын болады. Бірінші жағдайда көмірді катиондық адсорбент деп қарастырсақ, екінші жағдайда оны аниондық адсорбент деп қарастыруға болады. Егер көмірді алу және активтендіру аралық жағдайда жүретін болса, онда жоғарғы да айтылған бірінші мен екінші топтарымыз бірдей түзіледі де, көміріміз амфотерлік қасиет көрсетеді. Мысалы:
Бұндай аралық жағдайда ерітіндінің рН-ы алмасу адсорбциясы нәтижесінде өзгермейді. Егер анықтап қарасақ көмірдегі алмасу адсорбциясының А.Н.Фрумкин және Н.А.Шилов жасаған теориялары бір-бірін жоққа шығармайтынын, бір құбылысты әртүрлі көзқараспен түсіндіретінін байқауға болады.
МАЗМҰНЫ
|
|

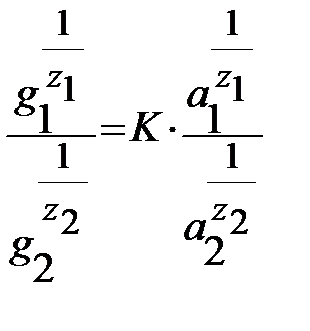
 және
және  - ерітіндідегі алмасатын иондардың активтіліктері.
- ерітіндідегі алмасатын иондардың активтіліктері. )
) ) орнына электролиттің концентрациясын қоюға болады:
) орнына электролиттің концентрациясын қоюға болады: